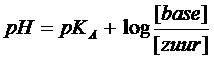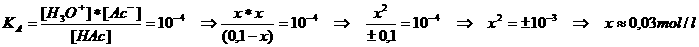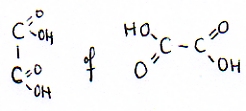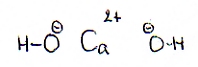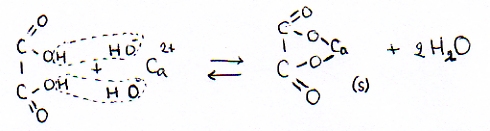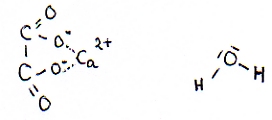I.
Periode 2,
Li - F
|
Verbindingen met Waterstof (hydriden)
|
LiH BeH2 BH3 {CH4} NH3 H2O HF
|
|
Sterke Base ---------------------zwakke base - neutraal - zwak zuur
|
|
Van links naar rechts zien we een geleidelijke overgang van base naar zuur, waarbij water een echt neutrale stof is en CH4 ook, maar om andere redenen dan water. Het hydride-ion (H-) is zeer basisch en kan worden afgestaan door LiH en BeH2. BH3 en NH3 hebben de neiging om H+ op te nemen, dus zijn zwak basisch, waarbij NH3 zwakker is dan BH3.
|
|
Verbindingen met waterstof én zuurstof
|
LiOH Be(OH)2 B(OH)3 = H3BO3 H2CO3 (=H4CO4) HNO3 [H2O] HFO3
|
|
Base ---------------------------amfoteer ----------- zwak zuur -------- sterk zuur
|
|
Van links naar rechts heb je weer een verandering van base naar zuur, waarin water ook een stof is met waterstof en zuurstof en dat blijft buiten deze analyse.
Het element B verbonden met zuurstof en waterstof kan Boriumhydroxide vormen óf Boorzuur (kan één H afsplitsen). Die twee zijn gelijk, zijn hetzelfde. Deze stof noemen we een amfotere stof of wel een amfolyt.
|
|
II.
Periode 3,
Na - Cl
|
Verbindingen met Waterstof (hydriden)
|
NaH MgH2 AlH3 {SiH4} PH3 H2S HCl
|
|
sterke base --------------- zwakke base - zwak zuur - sterk zuur
|
Van links naar rechts zien we een verandering van basisch naar zuur, met SH4 om diverse redenen neutraal.
Het ion H- is zeer basisch en kan worden afgestaan door LiH en BeH2. BH3 en NH3 hebben juist de neiging om ionen H+ (protonen) op te nemen. waarbij NH3 zwakker base is dan BH3.
|
|
Verbindingen met waterstof én zuurstof
|
NaOH Mg(OH)2 Al(OH)3=H3AlO3=HAlO2 H4SiO4=H2SiO3 H3PO4 H2SO4 HClO3
|
|
Base ---------------- amfoteer ------------ zwak zuur --------- sterk zuur
|
Van links naar rechts heb je een verloop van basisch naar zuur.
Het element Al, verbonden aan zuurstof en waterstof, kan een amfotere stof opleveren.
|
|
III.
Groep 1,
Li – Cs
|
Verbindingen met Waterstof (hydriden)
|
LiH - NaH - KH - RbH - CsH (Het zijn allemaal hydriden)
|
|
Base --------------------- zeer sterke base
|
|
Het ion H- is een ion met een zeer sterk basisch karakter
|
|
Verbindingen met waterstof én zuurstof
|
LiOH NaOH KOH RbOH CsOH
|
|
Base --------------------------- zeer sterke base
|
Het zijn allemaal sterke basen door de aanwezigheid van het ion OH-
Het zijn allemaal ionbindingen. De ionstralen van de positieve ionen nemen toe van boven naar beneden.
|
|
IV.
Groep 5,
N - Bi
|
Verbindingen met Waterstof (hydriden)
|
NH3 PH3 AsH3 SbH3 BiH3
(Allemaal zijn het hydriden)
|
|
zwakke base --------------------- sterke base
|
|
Het ion H- is een ion met een zeer sterk basisch karakter
|
|
Verbindingen met waterstof én zuurstof
|
HNO3 H3PO4 H3AsO4 H3SbO4
H3BiO4
|
|
sterk zuur --- zwakker zuur --- amfoteer --- zwakke base
|
|
Van boven naar beneden verliezen deze stoffen hun zure karakter
|
|
V.
Groep 6
O - Po
|
Verbindingen met Waterstof (hydriden)
|
H2O H2S H2Se H2Te H2Po
|
|
amfoteer ----- zwak zuur -------- sterkere zuren
|
|
Het ion H- is een ion met een zeer sterk basisch karakter
|
|
Verbindingen met waterstof én zuurstof
|
H2O H2SO4 H2SeO4 H2TeO4 H2PoO4
|
|
amfoteer---- sterk zuur ------ zwakkere zuren
|
|
|
|
VI.
Grupo 7,
F - At
|
Verbindingen met Waterstof (hydriden)
|
HF HCl HBr HI HAt
|
|
zwak zuur ------- sterke zuren
|
|
|
|
Verbindingen met waterstof én zuurstof
|
(HFO3) HClO3 HBrO3 HIO3 HAtO3
|
|
Bestaat niet sterk zuur ------- zwakkere zuren
|
|
|
|
Het is de bedoeling dat je een aantal zuur-base reacties gaat onderzoeken aan de hand van onderstaande 8 aktiepunten.
|
Zo mogelijk krijg je in een praktikumlokaal de benodigde stoffen. Anders blijft het bij een gedachtenexperiment.
Na elke waarneming moet je proberen een (voorlopige) konklusie te trekken.
|
| De 8 aktiepunten voor elke reactie zijn: |
De te onderzoeken reacties zijn: |
- Welke deeltjes zijn bij de reactanten aanwezig? (ionenformules, molecuulformules, structuurformules.)
- Welke van die deeltjes zijn de sterkst aanwezige zuur en base en tot welke kategorie behoren zij?
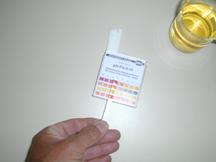
- Onderzoek de oplossingen met lakmoespapier en metuniverseel indikatorpapier of een pH-meter. De afgelezen zuurtegraad moet je noteren. Let op: het zuur in een brede reageerbuis.
- Schrijf de protolysereacties op van het zuur en de base. Indien het zuur of de base méér dan één proton kan afstaan of opnemen, schrijf dan meerdere protolysereacties op.
- Schrijf de totaalreactie op; zoveel mogelijk met ionenformules. Aan welke kant ligt het evenwicht?
- Schrijf de formules op van de producten. (ionen-, molecuul- en structuurformules)
- Voeg aan het zuur enkele druppels indikator toe en voeg daarna met kleine beetjes tegelijk de base toe aan het zuur. Noteer de waarnemingen en kontroleer of deze overeenkomen met de totaalreactie en met de tabel.
- Zijn er vervolgreacties? Zo ja, schrijf ze op.
|
- Oxaalzuur(aq) + Kalkwater
- 1M zoutzuur + IJzer(II)sulfide (in de zuurkast)
- Aluminiumsulfaat + 1M Natronloog
- Fosforzuur(aq) + Krijt(s)
- Ammoniumchloride + Kaliloog
- Uitgeademde lucht langdurig doorblazen (rietje) in Kalkwater.
|
Welke deeltjes zijn bij de reactanten aanwezig? (ionenformules, molecuulformules, structuurformules.)
|
oxaalzuur (aq) |
kalkwater |
| ionenformules |
2H+ en C2O42- |
Ca2+ en OH- |
| molecuulformules |
H2C2O4 |
Ca(OH)2 |
| structuurformules |
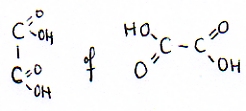 |
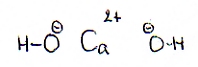 |
|
|
Welke van die deeltjes zijn de sterkst aanwezige zuur en base en tot welke kategorie behoren zij?
sterkst aanwezige zuur is het oxaalzuur H2C2O4
sterkst aanwezige basis moet zijn: OH-
|
|
Onderzoek de oplossingen met lakmoespapier en met universeel indikatorpapier of een pH-meter. De afgelezen zuurtegraad moet je noteren. Let op: het zuur in een brede reageerbuis.
In de praktijk zal blijken: de zuuroplossing krijgt met lakmoes een rode kleur en de kalkwater oplossing wordt blauw.
De overige gegevens kunnen alleen met de juiste apparatuur worden afgelezen
|
|
Schrijf de protolysereacties op van het zuur en de base. Indien het zuur of de base méér dan één proton kan afstaan of opnemen, schrijf dan meerdere protolysereacties op.
zuur:
H2C2O4  2H+ + C2O42-
H2C2O4 2H+ + C2O42-
H2C2O4  H+ + HC2O4-
HC2O4- H+ + HC2O4-
HC2O4-  H+ + C2O42- H+ + C2O42-
base:
OH- + H+  H2O H2O
|
|
Schrijf de totaalreactie op; zoveel mogelijk met ionenformules. Aan welke kant ligt het evenwicht?
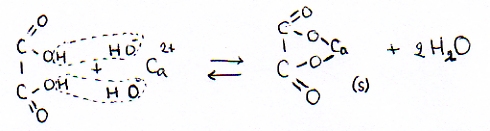
omdat er een neerslag wordt gevormd (het zout calciumoxalaat) verdwijnen de producten uit het evenwicht. Oftewel: het evenwicht schuift helemaal naar rechts, naar de producten.
|
|
Schrijf de formules op van de producten. (ionen-, molecuul- en structuurformules)
|
|
calciumoxalaat(s) en water
|
| ionenformules |
Ca2+ en C2O42- (in een ionrooster) |
| molecuulformules |
CaC2O4(s) en H2O |
| structuurformules |
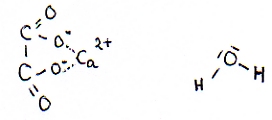 |
|
|
Voeg aan het zuur enkele druppels indikator toe en voeg daarna met kleine beetjes tegelijk de base toe aan het zuur.
Noteer de waarnemingen en kontroleer of deze overeenkomen met de totaalreactie en met de tabel.
Alleen uit te voeren in het laboratorium. Maar je zult zien dat elke keer de kleuromslag plaats vindt.
|
|
Zijn er vervolgreacties? Zo ja, schrijf ze op.
In eerste instantie worden oxalaat-ionen en water gevormd, maar meteen blijkt dat de Calcium-ionen (van het kalkwater) met de oxalaat-ionen een slecht oplosbaar zout vormen; er zal dus een neerslagvorming gezien worden. Er vormt zich een vast stof. De oplossing wordt wit-troebel.
|
|
-
Maak je keuze; kies twee stoffen die samen een goed buffermengsel kunnen vormen.
We kiezen bijvoorbeeld de stoffen ammoniumchloride en ammonia. D.w.z. we voegen dan samen: NH4+ionen en NH3.
Dan hebben we een geconjugeerd zuur-base paar.
Het ammonium-ion is het zwakke zuur en het ammoniak is de zwakke (geconjugeerde) base.
-
Maak het buffermengsel in een volume van ongeveer 100 ml en met een buffercapaciteit van 1 mol/l.
1 mol per liter betekent in de praktijk ongeveer 0,1 mol per 0,1 liter (=100 ml)
Dus moeten we samenvoegen: 0,1 mol ammoniumchloride en 0,1 mol ammoniak in water tot een eindvolume van 100 ml. Je kunt dit doen in een maatkolf van 100 ml die alvast een beetje gedestilleerd water bevat. Dan voeg je de twee stoffen toe en tenslotte vul je met water aan tot de merkstreep van 100 ml.
-
Bereken de pH met behulp van de bufferformule en kontroleerje berekening door die pH te meten met een pH-meter of met pH-papier.
De bufferformule:
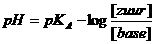
Het zwakke zuur is ammonium en dat heeft een pKA (zie tabel) van ongeveer 10
de concentraties van zuur en van base zijn gelijk en wel; 0,1mol/l. Dat kan ingevuld worden in de bufferformule
Je krijgt dan: pH = 10 - log 0,1/0,1 = 10
-
Verdeel het buffermengsel in twee delen van ongeveer 50 ml.
-
Voeg enkele druppels sterk zuur toe aan:
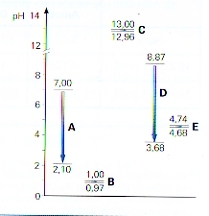
- 50 ml leidingwater waarvan je de pH al gemeten hebt
- 50 ml buffermengsel
Meet van beide oplossingen (dus na de toevoeging van het sterke zuur) de pH-waarden m.b.v. pH-indikatorpapier.
Dit kan alleen maar in de praktijk gedaan worden. Je kunt wel het volgende verwachten:
een paar druppels sterk zuur (zoals zoutzuur) toegevoegd aan gedestilleerd water zal meteen een flinke daling van de pH veroorzaken.
Het gedestilleerde water zou een pH van ongeveer 6 kunnen hebben en meteen na toevoeging van het zuur daalt die pH tot bijvoorbeeld 2.
Echter, als je datzelfde zuur toevoegt aan het buffermengsel met pH 10, dan zal de pH nauwelijks dalen. Bijvoorbeeld van 10 naar 9,9
Voeg enkele druppels sterke base toe aan:
- 50 ml leidingwater
- 50 ml buffermengsel
Meet van beide oplossingen (dus na de toevoeging van de sterke base) de pH-waarden m.b.v. pH-indikatorpapier.
Dit kan alleen maar in de praktijk gedaan worden. Je kunt wel het volgende verwachten:
een paar druppels sterke base (zoals natriumhydroxide) toegevoegd aan gedestilleerd water zal meteen een flinke stijging van de pH veroorzaken. Het gedestilleerde water zou een pH van ongeveer 6 kunnen hebben en meteen na toevoeging van de base stijgt die pH tot bijvoorbeeld 10.
Echter, als je diezelfde base toevoegt aan het buffermengsel met pH 10, dan zal de pH nauwelijks stijgen. Bijvoorbeeld van 10 naar 10,1
|
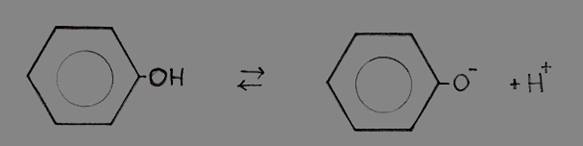
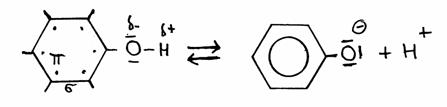
 geconjugeerde base + hydroniumion.
geconjugeerde base + hydroniumion.
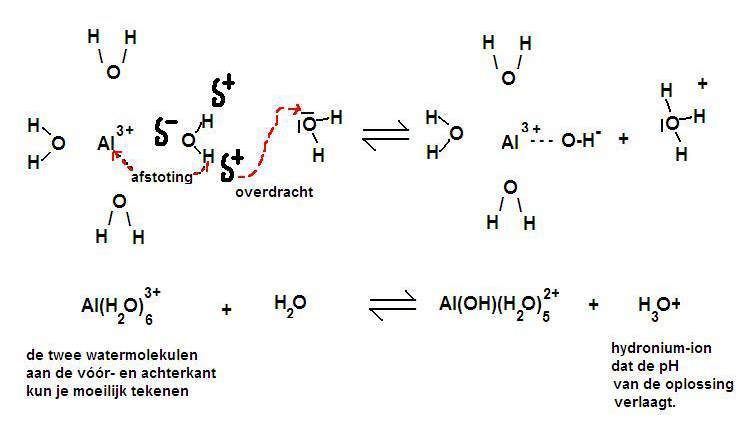
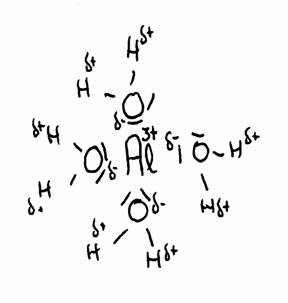





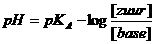 of
of