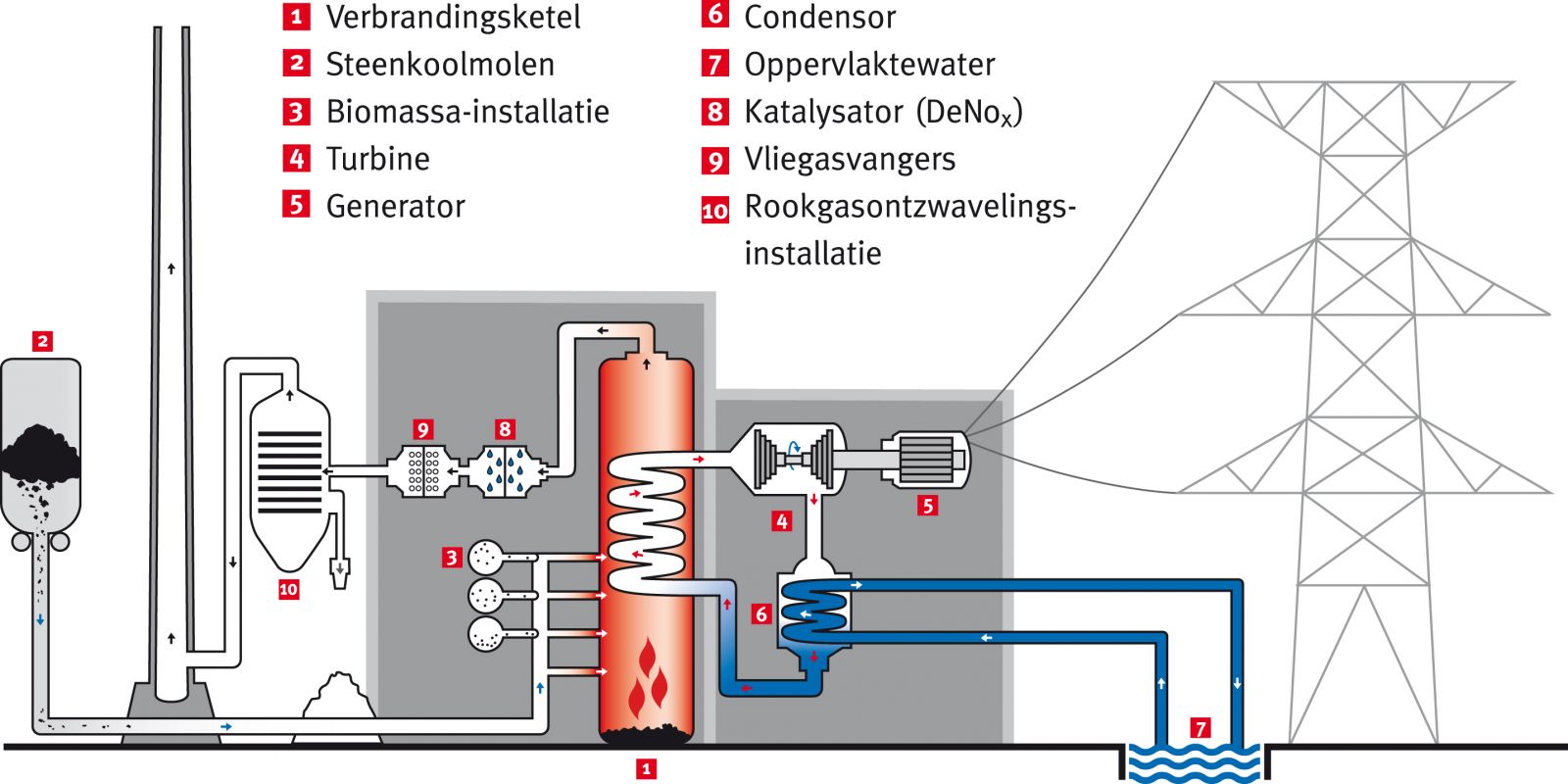
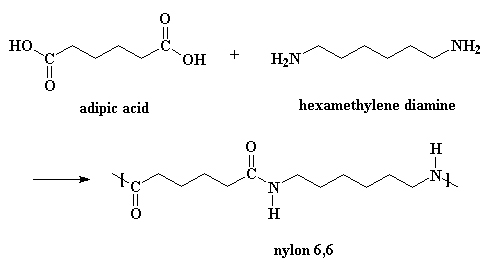
C(s) + O2(g)Vanzelfsprekend worden alle andere stoffen die in de steenkool zitten, mee verbrand. Daarbij moet je vooral denken aan Zwavel en Stikstof die bij verbranding oxiden opleveren: NO, NO2 en SO2. Deze oxiden kunnen in de lucht, met watere (regen) zuren veroorzaken (zure regen).CO2(g)

2C(s) +O2(g)2CO(g)
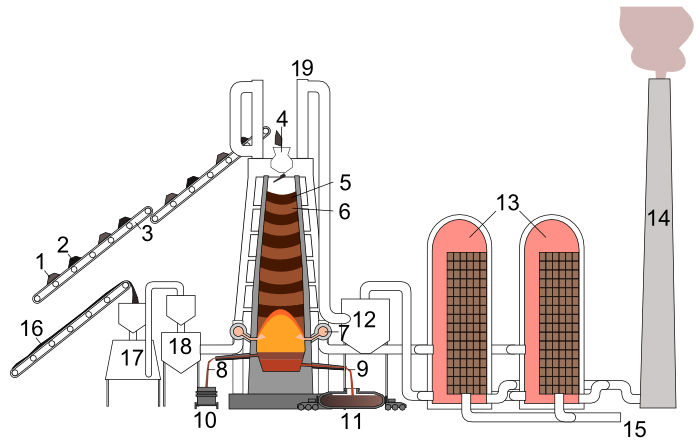
2C(s) +O2(g)Zuurstof uit de lucht verbrandt de koolstof uit de cokes en het poederkool; daarbij ontstaat koolstofmonoxide (CO). Het CO gas, dat een temperatuur van ongeveer 2200-2400°C heeft, stijgt op door de lagen cokes en erts heen.2CO(g)
Fe2O3(s) + 3CO(g)3 CO2(g) + 2Fe(l) (Reductie van ijzeroxide tot ijzer)

Fe3+ (aanwezig in ijzererts) + 3 e-Die elektronen worden geleverd door de reductor CO, die bij dit proces wordt omgezet in CO2. Daarover het volgende:Fe (eerst in het vloeibare, later gestolde ijzer)
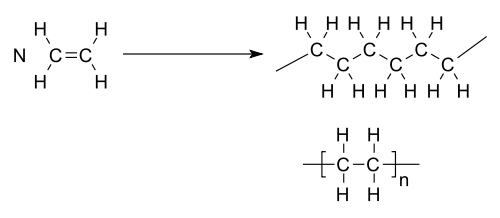
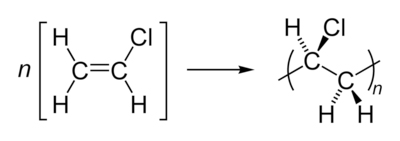
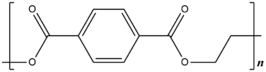
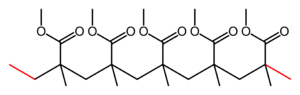
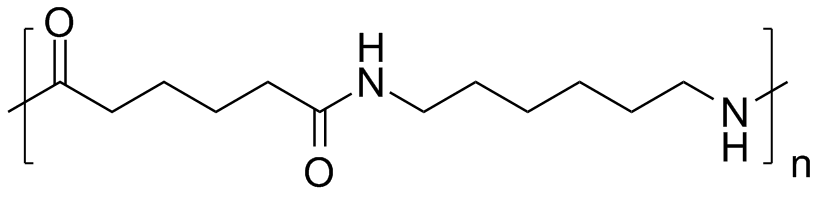


|
per molecuul |
||