|
Deze module gaat over atomen. Je leert hoe atomen in elkaar zitten en krijgt een eenvoudig idee van het atoombegrip.
Ook gaat het over de geschiedenis van hun ontdekking, over atoommodel, over belangrijkste eigenschappen van atomen. Daarnaast bespreken we ook de begrippen 'ion', 'atoommassa', 'elektronenformule' en radioactiviteit. |
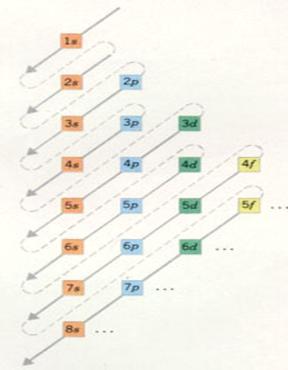
| Hoofdschil 1 bestaat uit slechts 1 subnivo, |
van het type s |
met een maximaal aantal elektronen van: |
2 |
| Hoofdschil 2 heeft 2 onderschillen, subnivo's |
van het type s en p |
met een maximaal aantal elektronen van: |
2 en 6 |
| Hoofdschil 3 heeft 3 subnivo's |
van het type s, p en d |
met een maximaal aantal elektronen van: |
2, 6 en 10 |
| Hoofdschil 4 heeft 4 subnivo's |
van het type s, p, d en f |
met een maximaal aantal elektronen van: |
2, 6 , 10 en 14 |
De hoofdschillen 5 tot 7 zouden zich - theoretisch - kunnen onderverdelen in 5, 6 en 7 subnivo's.
Maar zulke grote atomen bestaan helemaal niet; daar is de natuur niet aan toe gekomen. Dus: |
|||
| Hoofdschil 5 verdeelt zich in vier subnivo's |
van het type s, p, d en f |
met een maximaal aantal elektronen van: |
2, 6, 10 en 14 |
| Hoofdschil 6 verdeelt zich in drie subnivo's |
van het type s, p en d |
met een maximaal aantal elektronen van: |
2, 6 en 10 |
| Hoofschil 7 verdeelt zich in twee subnivo's |
van het type s en p |
met een maximaal aantal elektronen van: |
2 en 6 |

| Deeltje | Massa (g) | Massa (a.m.e) | Lading |
| Elektron | 9,1*10-28 | 0 | -1 |
| Neutron | 1,67495*10-24 | 1 | 0 |
| Proton | 1,67254*10-24 | 1 | +1 |
| Natrium | geel | Koper | groen | |
| Kalium | zwak violet | Tin | blauw | |
| Calcium | rood | Lood | zwak blauw |