De wijze natuurwet
Het leukste van de chemie vind ik de reacties. Stoffen reageren met elkaar waarbij nieuwe stoffen ontstaan, vaak zonder dat de oude stoffen helemaal verdwijnen overigens.
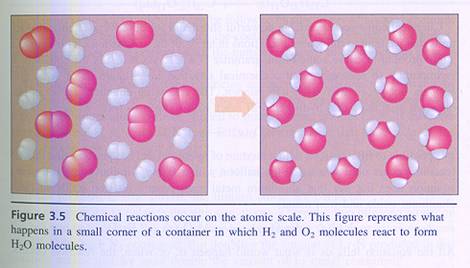
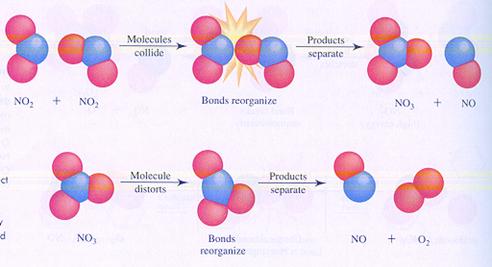
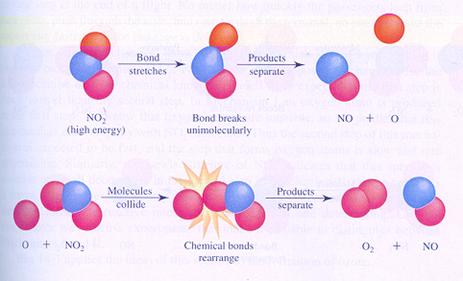
Bijzonder is dat het reageren vooral gebeurt in de ontmoeting, de botsing. Als deeltjes, zoals atomen, ionen en moleculen elkaar ontmoeten is er kans dat ze reageren en iets nieuws opleveren.
Let wel: dat nieuwe is helemaal opgebouwd uit oude onderdelen. Aan elkaar gekoppelde atomen laten elkaar los en gaan op een andere manier weer koppelen.
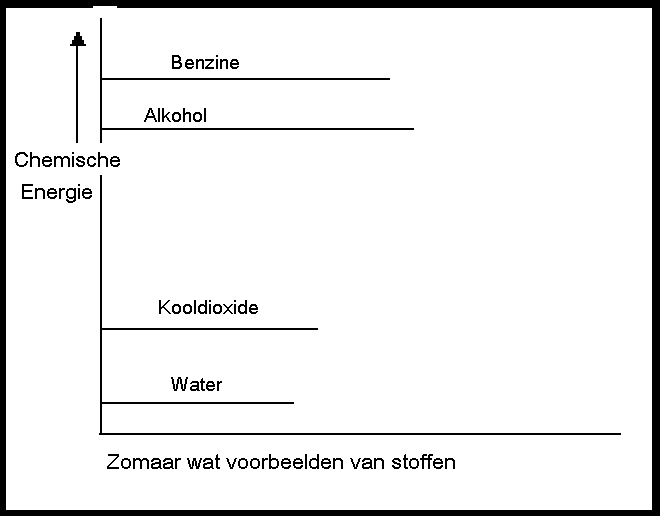
Woorden als 'verbinden' en 'scheiden' spelen hier een rol. De natuur heeft ook hier iets leuks in petto: verbinden (deeltjes aan elkaar koppelen) levert haast altijd nieuwe energie op, maar scheiden (of ontleden, uit elkaar halen) kost energie.
Solitaire deeltjes vind je dan ook heel weinig in de natuur. Vrijwel alle stoffen zijn verbindingen. Wel zijn sommige verbindingen stabieler dan andere.
Vaak is er sprake van evenwicht. Stoffen reageren dan wel, en de producten kunnen weer door reageren, enzovoort, maar als de natuur vindt dat de boel uit balans geraakt, gaat het rustig weer de andere kant op en wordt een fout evenwicht weer recht getrokken.
Hoe aardig is het om te merken dat in de natuur elk evenwicht wordt bereikt doordat de sterken zich opofferen voor de zwakkeren. Als twee sterke stoffen met elkaar reageren, levert dat altijd zwakkere stoffen op, van de sterke blijft wel degelijk wat over, maar veel is het niet. Er is evenwicht.
Stop je er echter stiekem wat van de zwakkere stoffen bij, dan zal het evenwicht er voor zorgen dat in dat geval toch weer wat extra sterke stoffen worden terug gevormd.Wij mensen kunnen er wat van leren, van zulke natuurwetten.
|
2. Chemische reacties en Energie |
|
3.1 reactiemechanisme / effectieve botsingen |
|
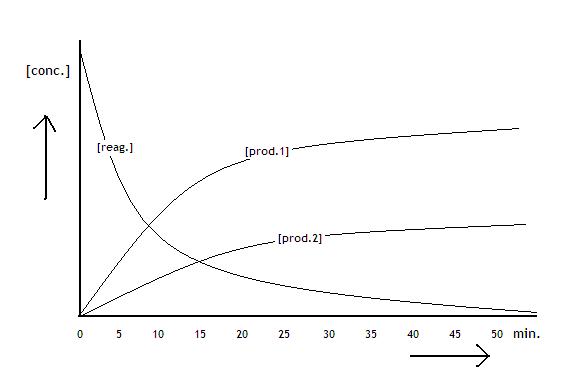
.1 Vormings- en ontledingsreacties |
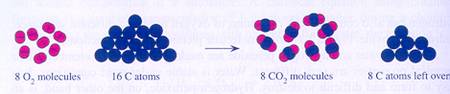
| De deelnemende deeltjes hergroeperen zich |
| Belangrijkste regels bij het oplossen van een reactieberekening: | |
| 1 | Een kloppende reactievergelijking opstellen en de aggregatietoestanden (de fasen) toevoegen. |
| 2 | Onderstreep de stoffen waarover gegevens bestaan en waarover vragen gesteld worden. De andere stoffen hoef je niet mee te nemen.
Die gegevens worden soms direct, soms indirect gegeven. De berekening doe je alleen met de onderstreepte stoffen. |
| 3 | Noteer de molverhouding |
| 4 | Waar nodig zet je mol om in de juiste eenheden (die vind je bij gegevens en bij het gevraagde) |
| 5 | Voer een omrekeningsfactor in om recht te doen aan de werkelijke hoeveelheden, zoals blijkt uit de gegevens.
Zo beëindig je de berekening. |
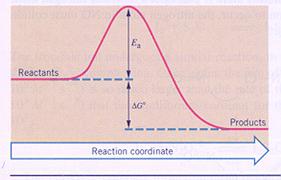
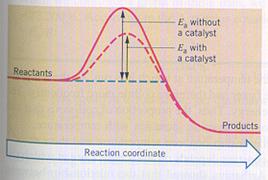
| I | De producten hebben méér energie dan de reagentia | In dit geval hebben de producten dus energie gewonnen, wat alleen kan als het systeem van buitenaf energie heeft verkregen (ΔH > 0). |
| II | De producten hebben minder energie dan de reagentia | Hier hebben de reagentia dus energie verloren; het systeem heeft energie afgestaan naar buiten (ΔH < 0). |
| III | De producten hebben evenveel energie als de reagentia | In dit geval is er sprake van een chemische evenwichtsreactie (ΔH = 0). |

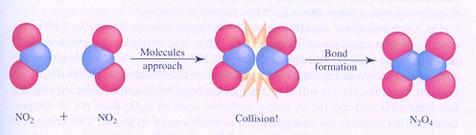
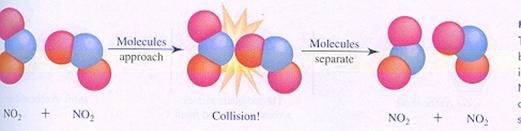
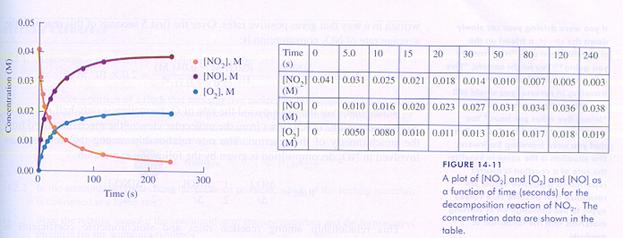
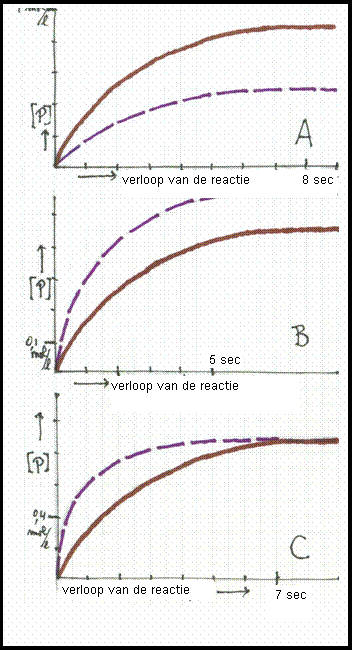
| Cl2 | 2 Cl· | V = k*[Cl2] | 2NO2 | N2O4 | V = k*[NO2]2 |
| CH3I + OH- | CH3OH + I- | V = k*[CH3I]*[[OH-] |
| Vtotal = | |
| Evenwicht 1 heeft als voorwaarde: |
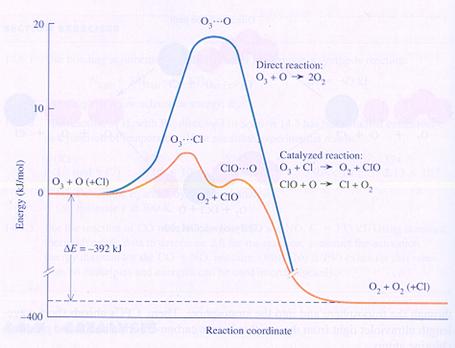
| ΔS >0 |
| de vrije energie, met het symbool G |