Bezitten één of meer carboxylgroepen (-COOH) (hierover veel meer in module 11 over de koolstofchemie)
Je moet enkele bijzondere types kennen: koolzuur, vetzuur, aminozuur, fenol
De carboxylgroep kan een ion H+ afgeven, oftewel, de carboxylgroep is een zuur (een zwak zuur meestal)
De hydroxigroep geeft normaal geen H+ af, alleen als die gekoppeld is aan een benzeenring (fenol)
Voor meer informatie over de zuren, zie de modules over deze onderwerpen.
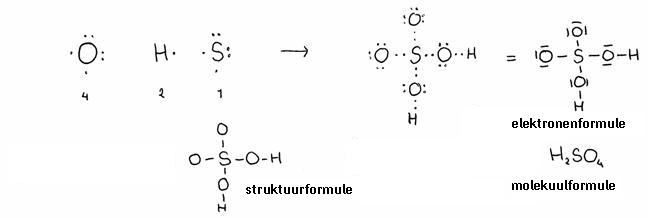
Dit zijn de niet-organische zuren die het element zuurstof bevatten.
Meestal kunnen die gemaakt worden, uitgaande van het betreffende oxide (bijvoorbeeld: zwaveltrioxide met water geeft zwavelzuur)
Deze zuren kunnen in naamgeving variëren, afhankelijk van het minimale en maximale aantal zuurstofatomen in het molecuul (dat heeft weer te maken met het zgn. oxidatiegetal (zie module "redoxreacties"). Zo heb je H2SO3 en H2SO4
Ook de geconjugeerde basen van deze zuren krijgen een eigen naam.
voorbeeld:
fosforzuur = H3PO4. (wordt gemaakt van P2O5 met H2O)
Als de formule niet H3PO4 is, maar H3PO3, dan krijgt dit zuur de naam: fosforigzuur.
| Zuur | zuurrest | voorbeeld | voorbeeld |
| onder(hypo).......igzuur | onder(hypo).......iet | hypochlorigzuur | hypochloriet |
| ......igzuur | ......iet | chlorigzuur | chloriet |
| ......zuur | ......aat | chloorzuur | chloraat |
| (hy)per.......zuur | (hy)per.......aat | (hy)perchloorzuur | (hy)perchloraat |
N.B.
Niet alle zuurstofhoudende zuren hebben alle vier mogelijkheden
Allemaal hebben ze de normale '...zuur' en '...aat'
Sommige hebben ook '...igzuur' en ...iet'
Hypo en hyper zijn tamelijk uitzonderlijk
De best bekende van dit type is HCl, zoutzuur
De formule begint altijd met H, direct gevolgd door een ander element, zonder zuurstof dus (HBr, HI, HCN, etc.)
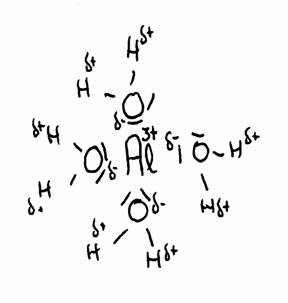
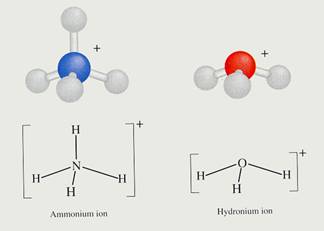
Het meest beroemde voorbeeld is het aluminium-ion in water opgelost, maar er zijn er veel meer. Kationen zijn vrijwel altijd meerwaardige gehydrateerde positieve metaalionen: Al(H2O)63+, Cu2+, Fe2+ of Fe3+, en nog veel meer andere, zijn altijd in water gehydrateerd.
hydratatie
De positieve ionen trekken, in watermilieu, de negatieve kanten van de watermoleculen aan, om zich heen.Vervolgens veroorzaken ze een afstotende werking tussen het centrale positieve ion en de δ+)ladingen van de H-atomen van de watermoleculen. Er is dan een neiging om H+ af te stoten.
Een oplossing van, bijvoorbeeld IJzer(III)chloride kan op die manier een behoorlijk zure pH verkrijgen.
De tekening laat de aantrekking zien tussen Al3+ en het δ- deel van zuurstof en het δ+ deel van waterstof.
De watermoleculen (in totaal 6) omgeven het 3+ ion van Aluminium omdat dit positieve ion de δ- van water om zich heen trekt.
Zodoende wordt de afstand tussen 3+ en δ+ steeds korter en daarmee de afstoting tussen 3+ en δ+ steeds sterker.
Het gevolg is dat de H min of meer kan worden afgestoten. Er kan afgifte zijn van H+-ionen, en dat noem je: een zuur karakter. (zie veel meer hierover in module 9)
Opdracht 9
Leg het zure karakter uit van het ammonium-ion, door alleen maar een reactievergelijking op te schrijven.
antwoord 04-09
Normaal zullen negatieve ionen H+ ionen willen aantrekken, en dan noem je het een base.
Toch kunnen bepaalde negatieve ionen als zuur dienen, dus H+ afgeven. Bijvoorbeeld: HCO3-.
Opdracht 10
De negatieve ionen die kunnen dienen als zuur, moeten wel amfoteer zijn. Leg deze bewering uit met een reactievergelijking.
2.2 Verschillende types basen
Er bestaan ook diverse types basen, hetzij zwak, hetzij sterk:- Organische moleculen
Daarbij kun je denken aan amines, en aan de aminozuren. (zie module 11)
- Negatieve ionen
In principe kunnen alle negatieve ionen H+ ionen ontvangen, opnemen. Dus het zijn altijd basen, sterke of zwakke.
- Sommige positieve ionen
Die kationen, nadat ze H+ hebben afgegeven, kunnen dat H+ ion ook weer terug opnemen en zo als base optreden.
- Sommige neutrale moleculen. Hierover later meer.
Meer informatie over zuren en basen kun je vinden in module 9: zuur-base-reacties.
Opdracht 11
- Geef de structuur van een triprotonisch organisch zuur.
- Geef de structuren en namen van 5 amfotere deeltjes.
- In de tabel met zuren en basen, welke formules daarin zijn van de kationzuren?
- Bewering: "zuren met negatieve lading zijn altijd amfolyt". Is dat waar? Leg uit.
- Gegeven zijn de volgende stoffen, keukenzout, gebluste kalk, ongebluste kalk, krijt, soda.
Bevatten deze stoffen zuren of basen?
2.3 Moleculen
Bij de nomenclatuur van moleculen gebruikt je vaak voorvoegsels: mono, di, tri, enz.Voorbeeld: N2O4 wordt genoemd: distikstof tetraoxide.
Het gebruik van voorvoegsels beperkt zich tot die situaties waar verwarring kan optreden bij het weglaten ervan.
voorvoegsels die je moet kennen:
mono, di, tri, tetra, penta, hexa, hepta, octa, nona, deka
Voorbeeld:
"koolstofoxide" is niet genoeg als naam omdat er twee van bestaan: CO en CO2
CO noemen we kool(stof)mon(o)oxide en de ander is kool(stof)dioxide. De delen tussen haakjes worden informeel vaak weggelaten.
Moleculen van een element met waterstof krijgen vaak traditionele namen als ammoniak, water, methaan, en meer.
In de organische chemie bestaat een heel uitvoerig systeem met voorvoegsels.
Meta, eta, propa, buta en dan verder zoals bekend: penta, hexa, nona, deka enz.
Meer hierover verderop.
Tenslotte nog dit: er zijn zouten die - ingesloten in het ionrooster - watermoleculen bevatten. Het blijven vaste stoffen, maar bezitten watermoleculen en we noemen dit: hydraten.
Voorbeeld: Koper(II)sulfaat pentahidraat; en een ander voorbeeld: Na2CO3.10H2O.
Opdracht 12
Tabel XI van het tabellenboek is de tabel met "oplosbaarheid van zouten in water".
Maak met deze tabel - door positieve en negatieve ionen te kombineren - minstens 20 verschillende combinaties en geef daarvan namen en formules.
Opdracht 13
Een beetje scheikundecursist moet de ionen in deze tabel gewoon kennen. Leer ze dus uit het hoofd.
3. Het koolstofatoom
Om meerdere redenen is het Koolstofatoom heel speciaal:- elk koolstofatoom kan vier bindingen aangaan, wat veel is in vergelijking met andere atomen.
- Het koolstofatoom verbindt zich gemakkelijk met andere koolstofatomen. Silicium doet dat ook min of meer, maar verder 'houden atomen daar niet van'. Meestal koppelen atomen liever aan atomen van een ander type. Er is een voorkeur voor het koppelen van verschillende elementen. Behalve bij Koolstof dus.
Om dat allemaal te begrijpen is het nodig je te verdiepen in de "orbitalen" van het koolstofatoom. Daarvan zijn er twee van belang voor het aangaan van bindingen: de onderschillen 2s en 2p.
Deze orbitalen kunnen op meerdere manieren samenwerken (bij het vormen van bindingen), o.a. kunnen ze zich met elkaar mengen en "hibriden" vormen:sp3, sp2, sp.
Hieronder een poging om dit duidelijker te maken:
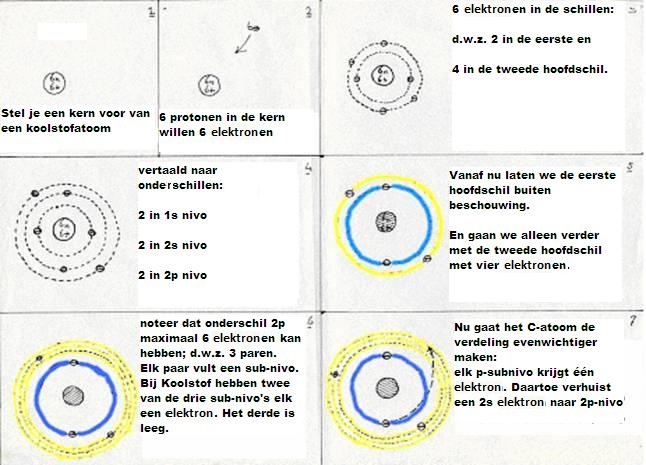
De subniveau's van koolstof zijn: 1s2 2s2 2p2
De eerste hoofdschil 1s2 ondergaat geen enkele verandering, wat het koolstofatoom ook doet, maar in de tweede hoofdschil vindt een soort reorganizatie plaats:
De vier valentie-elektronen (twee s en twee p) hebben een manier gevonden om tot een stabielere situatie te geraken:
- eerst: een elektron 2s wordt een elektron 2p (gaat dus wat verder van de kern af, en dat kost energie)
- daarna: 2s1 wordt 2p3 (deze verandering kost ook energie)
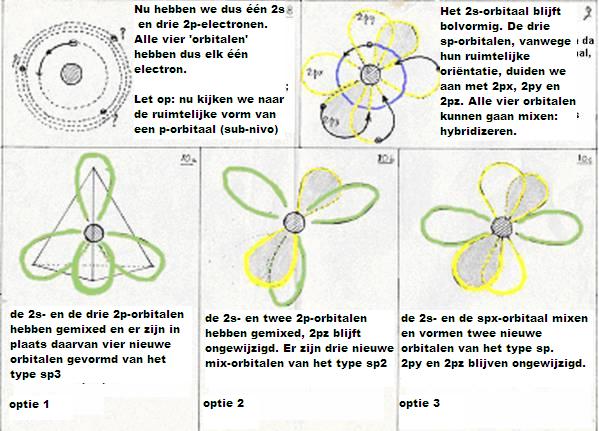
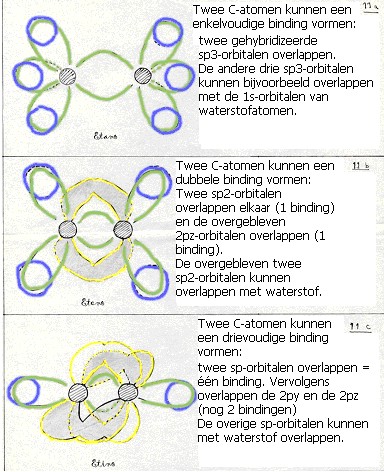
- tenslotte: de vier niveau's gaan nu mixen en hibrides vormen. ofwel: Eén 2s-orbitaal en drie 2p-orbitalen doen mee aan die hibridizatie. Ze vormen vier nieuwe orbitalen van het type sp3 (hierbij komt energie vrij = exotherm heet dat). Deze vier nieuwe en gelijke orbitalen zijn verantwoordelijk voor de vier (gelijkwaardige en enkelvoudige) bindingen van een koolstofatoom.
Naast deze sp3-hybridizatie bestaan er nog twee andere mogelijkheden:
- De eerste (even herhalen van hierboven) is dus het hybridiseren van een 2s-orbitaal met drie 2p-orobitalen tot vier nieuwe orbitalen van het type sp3
- De tweede mogelijkheid is dat één 2s- en niet drie, maar twee 2p-obitalen meedoen aan de hybridisatie.
Dan vormen zich drie nieuwe orbitalen van het type sp2
en er blijft één oude 2p-orbitaal over; die kan zorgen voor een extra binding.
(dubbele binding: 1 binding is dan van het type σ en één binding is dan π). - De derde mogelijkheid is dat één 2s-orbitaal en één 2p-orbitaal meedoen aan de hybridisatie.
Dan vormen zich twee nieuwe orbitalen van het type sp en blijven er twee oude 2p-orbitalen over;
zo kan een drievoudige binding ontstaan tussen twee C-atomen (één binding σ en twee bindingen π).
Opdracht 14
Bestudeer de volgende (strip)tekeningen, die nog eens het bijzondere C-atoom willen uitleggen.
Het waterstofatoom, heel verschillend van het koolstofatoom, is het eenvoudigste atoom met slechts één elektron. De elektronenverdeling is: 1s1.
Hier valt dus niets te hybridiseren. Het s-orbitaal heeft een ronde vorm en kan overlappen met elk ander type orbitaal van welk atoom dan ook (in de koolstofchemie is dat heel vaak een koolstofatoom).
Deze overlapping geeft altijd een σ-binding en levert altijd alleen maar enkelvoudige bindingen.
Opdracht 15
Leg uit waarom waterstof alleen maar enkelvoudige bindingen vormt.
Opdracht 16
Wat betekent het symbool: sp2 (leg dat in eigen woorden uit)
Opdracht 17:
Wat voor bindingstypes kom je tegen in een molecuul van propeen?
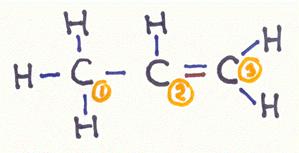
antwoord 04-17
Hoofdstuk 4. Koolstofketens
4.1 Inleiding
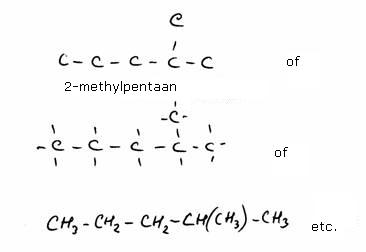
De hoeveelheid stoffen in de organsiche scheikunde (koolstofchemie) is onvoorstelbaar groot. De belangrijkste oorzaak is die mogelijkheid van koolstofatomen om aan elkaar te koppelen en korte of heel lange koolstofketens te vormen. Een goede nomenclatuur (naamgeving) met basisregels voor al die koolstofketens is daarom noodzakelijk.
Die ketens kun je in de scheikundeboeken op diverse manieren tegenkomen. Soms zijn ze heel gedetailleerd getekend, met alle atomen zichtbaar, soms zie je ze als een soort skelet, waarbij lang niet alle atomen en bindingen erbij staan.
Zonder kennis van de basisregels is het niet mogelijk de beroemde internationale nomenclatuur te begrijpen of te beheersen.
4.2 Hoofdketens en vertakkingen
Als consequentie van zijn bijzondere karakter kan het C-atoom ketens vormen met enkelvoudige, dubbele, drievoudige en zelfs cyclische bindingen, niet alleen met koolstof, maar met vele andere atomen.Er zijn zoveel verschillende moleculen gebaseerd op het koolstofatoom, dat we spreken van een koolstofchemie, vroeger, maar eigenlijk kom je dat nog heel vaak tegen, spraken we van organische chemie.
primair, secundair, tertiair en quaternair
Onderstaande structuur is 'methylbutaan' aan de linkerkant en 'dimethilpropaan' aan de rechterkant.Koolstofatomen die alleen maar gekoppeld zijn aan één ander C-atoom heten primaire C's; deze zitten altijd aan het eind van een koolstofketen.
C-atomen tussen twee andere in noemen we secundaire C-atomen.
Zo zijn er ook tertiaire C-atomen, gekoppeld aan drie andere, en quaternaire die ingeklemd zitten tussen vier andere C-atomen.
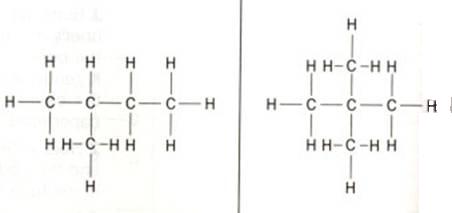
Opdracht 18
Hoeveel primaire, secundaire, tertiaire en quaternaire C-atomen zitten in de twee structuren?
De woorden primair, enz. gebruikt men niet alleen voor de C-atomen. Ook andere atomen of atoomgroepen kunnen deze kwalifikatie bezitten.
Als bijvoorbeeld een OH-groep vast zit aan een secundair C-atoom, spreken we van een secundaire alkohol of ook van een secundaire hydroxigroep.
Bij de eiwitten zul je ook die termen primair, enz. tegenkomen, maar dan betekenen ze iets anders.
Opdracht 19
Beantwoord de volgende vragen over de structuren A, B, C en D:
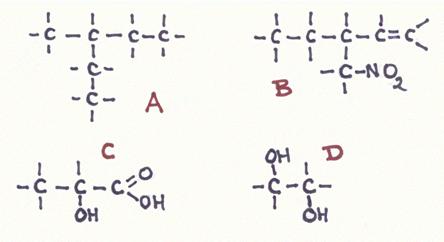
- Geef de officiële naam van elke structuur;
- Hoeveel secundaire koolstofatomen heeft elke structuur?
- Zie je ergens een secundaire OH-groep? Waar?
- Zijn alle hoofdketens tegelijk ook de langste ketens?
antwoord 04-19
4.3 Nomenclatuur
Opdracht 20Welke specifieke groepen herken je in de structuur?
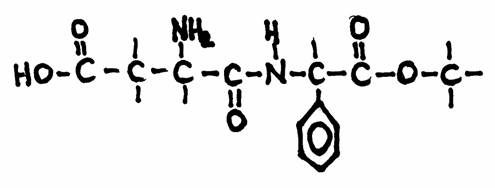
Dit is de structuur van 'aspartaam', een vervanger voor gewone suiker voor personen die op moeten passen (diabetici, of mensen die bang zijn om dik te worden).
Aspartaam heeft een effect 100x zo sterk als gewone suiker:
1 gram suiker kun je vervangen door 10 mg aspartaam
andere vervangers zijn: fructose (1,7x suiker) en sacharine (400x suiker)
De koolstofverbindingen bevatten altijd een hoofdketen van koolstofatomen. In de nomenclatuur is het eerste wat je doet: de hoofdketen opzoeken en herkennen.
- Kies als hoofdketen altijd:
- de langst mogelijke keten, maar ook en tegelijk:
- die keten waar eventuele dubbele of drievoudige bindingen in zitten.
- De hoofdketen kan vertakkingen hebben of functionele groepen zoals een OH-groep
- Indien nodig voeg je nummers toe om aan te geven aan welke plaats in de hoofdketen de vertakking, de speciale bindingen of functionele groepen aangekoppeld zitten. Daarbij moet je altijd proberen een zo laag mogelijke nummering te krijgen.
Met..., et..., prop..., but..., pent..., hex..., hept..., oct..., non..., dec..., in het algemeen: alc...
op de puntjes verschijnen achtervoegsels:
- aan: de hoofdketen heeft alleen enkelvoudige bindingen.
- een: de hoofdketen heeft ook dubbele bindingen.
- yn: de hoofdketen heeft ook drievoudige bindingen
- yl: dan gaat het over een vertakking, dus niet de hoofdketen.
Voorbeelden:
Propeen is een molecuul met een keten van drie C-atomen met een dubbele binding.
De positie van de dubbele en drievoudige bindingen worden met nummers aangegeven, indien nodig.
3-etyl is een vertakking, een zijtak, van twee C-atomen, en die gekoppeld is aan de derde C van de hoofdketen.
Behalve achtervoegsels zijn er ook vele voorvoegsels:
- Mono, di, tri, tetra, penta, hexa, hepta, octa, nona, deca
zij duiden 1 tot 10 aan en geven het aantal van een bepaald groepje. - Ciclo
dan is de hoofketen niet lineair, maar circulair.
Voorbeeld: 3,4-dimetyl,1-hexeen:
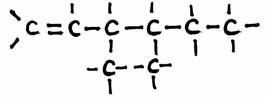
N.B
H-atomen kunnen eventueel weggelaten worden in de structuurformule.
Opdracht 21
Zo mogelijk moet je nu met modellen gaan werken en proberen de volgende moleculen te bouwen:
metaan (ruimtelijke vorm heet hier: tetraëder); benzine (de belangrijkste isomeer van octaan); etheen; acetileengas (ethyn) dat gebruikt wordt bij lassen.
De koolwaterstoffen kunnen uit de aardlagen gehaald worden, diep onder de aarde of onder de zee of oceaan. Je treft ze aan in:
- ruwe aardolie
- aardgas
Op alle bijbehorende processen komen we later in andere modules terug. Nu gaat het alleen over de nomenclatuur.
De homologe reeks
zo'n reeks bevat stoffen met een één type functionele groep, met eenzelfde algemene formule en met gelijksoortige eigenschappen.Bijvoorbeeld: alle alkoholen hebben een OH-groep, een algemene formule CxHyOH. Maar je hebt ook ethers en esters enz. De verschillen tussen de leden van een homologe serie hangen onder andere af van de lengte van de koolstofketen CxHy.
Zo zal methanol veel gemakkelijker verdampen dan propanol. Maar chemisch vertonen ze veel gelijksoortige reacties.
(on)verzadigd
Een koolstofketen kan verzadigd zijn of onverzadigd, afhankelijk van de aanwezigheid van dubbele of drievoudige bindingen tussen de koolstofatomen.Later komen we terug op de typische reacties van onverzadigde bindingen, die namelijk geopend kunnen worden en dan 'verzadigd' worden door er iets aan toe te voegen.
4.4 Modellen

Nu we het hebben over de nomenclatuur van chemische stoffen, is het onvermijdelijk nader in te gaan op modellen.
We gebruiken in de scheikunde diverse modellen om dit onderwerp (ruimtelijke vorm van moleculen) zichtbaar te maken.



modellendoos soorten modellen C6H12O6
Nooit en te nimmer mag je vergeten dat een model niet meer is dan alleen maar een zeer vereenvoudigde uitbeelding van de werkelijkheid. Trek niet meer conclusies uit een model dan de makers van het model er mee willen uitleggen. Een model is altijd een versimpeling.
Maar aan de andere kant, een goed model helpt echt om beter te begrijpen waarom chemische stoffen zus of zo zich gedragen. Je zou eingenlijk een modellendoos moeten hebben.
Opdracht 22
Maak zelf de modellen die boven getoond werden in foto's.
5. Koolstofverbindingen met zuurstof en stikstof
Opdracht 23
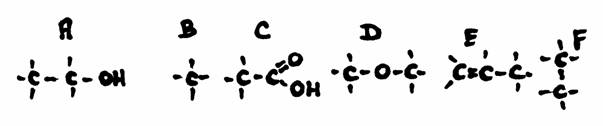
- Welke structuur is onverzadigd?
- Welke stoffen behoren tot eenzelfde homologe reeks?
- Welke stof reageert met natriumcarbonaat?
Opdracht 24
gegeven de volgende structuur:
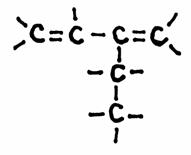
- Welke naam heeft deze chemische structuur?
- Controleer of de modellen van deze structuur (op de foto's) in orde zijn.
- Vergelijk ze met elkaar. Geef je commentaar op elk model.
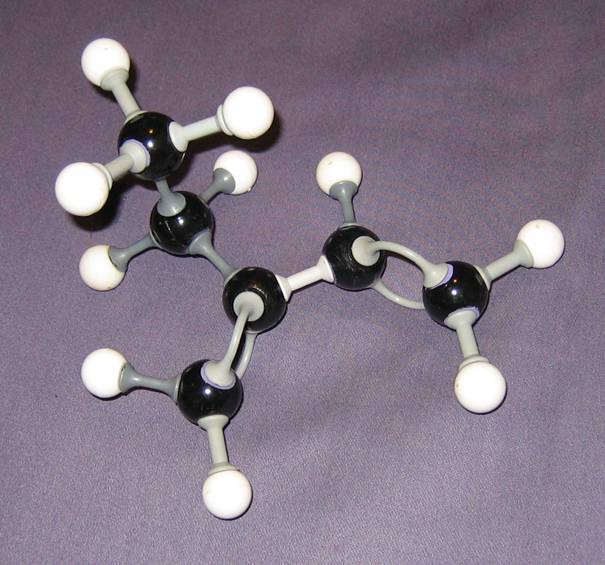


antwoord 04-24
5.1 Organische verbindingen met zuurstof
Enkele regels voor de nomenclatuur| Voorvoegsels: | |
| Hydroxi | betekent een OH-groep gekoppeld aan een C-keten |
| Alkoxi | Een zijketen zit via een zuurstofatoom gekoppeld aan de hoofdketen (ether) |
| Achtervoegsels: | |
| ol | Net als hydroxi: een OH-groep aan de hoofdketen.
De OH-groep heeft dus twee mogelijkheden voor naamgeving. |
| al | een zuurstofatoom zit dubbelgebonden aan een primaire C van de hoofdketen |
| on | een zuurstofatoom zit dubbelgebonden aan een secundaire C van de hoofdketen |
| zuur | Betekent dat er een carboxylgroep (COOH-) aan de hoofdketen zit |
| (o)aat | de H van de carboxylgroep is afgestaan (en kan vervangen zijn door iets anders, of is negatief)
Het kan dus een zuurrest zijn, maar ook een ester |
| ose | een combinatie van al of on met enkele ol's |
Opdracht 25
Dit is een modelopdracht: bouw met molecuulmodellen de volgende moleculen: ethanol; aceton; formaline; azijnzuur; etaandizuur (=oxaalzuur; een ethergroep en een estergroep.
Opdracht 26
Zijn de volgende beweringen vals of waar? Leg je antwoord uit.
- 2-hidroxi,2-methylpropaan is gelijk aan 1-methyl,2-propanol.
- 2-hydroxi,2-methylpropaan is een tertiair alcohol.
5.2 Organische verbindingen met stikstof
Enkele regels voor de nomenclatuurHoofdnaam is: Amine = één of meer waterstofatomen van ammoniak zijn vervangen door alkylgroepen.
| voorvoegsels: | |
| amino | een NH2-groep gekoppeld aan de hoofdketen. |
| nitro | een NO2-groep gekoppeld aan de hoofdketen |
Opdracht 27
Van een ammoniakmolecuul werden vervangen:
- 1 H-atoom door een ethylgroep
- 1 H-atoom door een methylgroep
- 1 H-atoom bleef onveranderd
- Dit molecuul heet trimethylamine
- Dit molecuul is een secundair amine
Opdracht 28
Geef de officiële naam van Valine (één van de aminozuren)
antwoord 04-28
5.3 Plastics; synthetische polimeren
Dit hoort bij het onderwerp "macromoleculen". Die gaan we onder meer behandelen bij de paragraaf over biochemie, met natuurlijke polimeren.Hier beperken we ons tot enkele sinthetische polimeren, die door de mens in fabrieken worden gemaakt:
plastic, nylon, kunstrubber, polyether, polyester, en poly-additie producten (PVC bijvoorbeeld)
Enkele regels voor de nomenclatuur:
- Alle hiervoor reeds genoemde regels gelden ook voor de polymeren; alleen wordt het voorvoegsel 'poly' ervoor gezet.
- Dat betekent niets anders dan 'veel'.
Polymeren zijn altijd opgebouwd uit kleine eenheden, kleine moleculen die - in grote aantallen - aan elkaar worden gekoppeld, de polymeren vormen. - Die kleine eenheden noemen we 'monomeren'. (mono = 1; poly = veel)
- In het algemeen mogen we stellen dat de naam van een polymeer eenvoudigweg de naam is van de monomeer met het voorvoegsel 'poly'.
structuur van de polymeren
-
- homopolymeren: het macromolecuul is opgebouwd uit slechts één type monomeren.
- copolymeren: het macromolecuul is opgebouwd uit twee of meer typen monomeren.
-
- een macromolecuul kan een lineaire structuur hebben; het product is dan flexibel.
- een macromolecuul kan een vertakte structuur hebben; het product is dan stug, harder, zonder flexibiliteit.
-
- Tussen de macromoleculen kunnen dwarsverbindingen bestaan. Zulke producten blijven hard bij verwarming. We noemen die "thermoharders". Deze stoffen kunnen een soort rooster hebben, een driedimensionale structuur met dwarsverbindingen.
- Zo niet, dan heeft de structuur dus niet een duidelijke driedimensionale structuur, er is niet zoiets als een rooster.
Bij verwarmen wordt het product zachter en kan zelfs smelten. We noemen dit "thermoplasten".
- Tussen de macromoleculen kunnen dwarsverbindingen bestaan. Zulke producten blijven hard bij verwarming. We noemen die "thermoharders". Deze stoffen kunnen een soort rooster hebben, een driedimensionale structuur met dwarsverbindingen.
Toepassingen
| Polyetheen | Plastic zakken |
| polypropeen | plastic stoelen |
| polyvinylchloride (PVC) | plastic buizen voor waterafvoer e.d. |
| silicoon (keten van Si en O met alkylgroepen) | siliconenkit |
| nylon (polyamide) | kleren |
| synthetische rubber | autobanden |
| polyester en polyether | matrassen |
6. Isomerie
Een molecuulformule geeft vaak al enigzins aan wat de structuur zal zijn van het molecuul, maar vrijwel nooit is deze formule voldoende om de hele structuur meteen te kennen.Bijvoorbeeld, wat is de structuur van C3H7OH?
Waarschijnlijk zal het 1-hydroxipropaan zijn, maar 2-hydroxipropaan kan ook.
Nog lastiger is: C3H8O.
Dit kan ook één van de hydroxipropanen zijn, maar net zo goed metoxy-ethaan.
En de OH-groepen van glucose (C6H12O6), aan welke kant van het molecuul zitten die vast?
Nogmaals, kennis van de molecuulformule is niet automatisch genoeg om de structuur te kennen. Zelfs kan één molecuulformule meerdere structuren hebben. In dat geval spreken van 'isomerie'.
We onderscheiden meerder typen van isomerie, waaronder de volgende:
- Structuur-isomerie
- Isomerie van positie
- Isomerie van de keten
- Functionele isomerie
- Stereo-isomerie
- Cis-trans-isomerie
- Optische isomerie
Opdracht 29
Leg uit of de volgende beweringen juist of onjuist zijn:
- eenvoudige alcoholen (met één OH-groep) zijn functionele isomeren met ethers.
- zuren zijn niet isomeer met esters.
- propanal en propaan-1-ol zijn structuur-isomeren
Opdracht 30
Kijk goed naar de twee structuren van glucose:
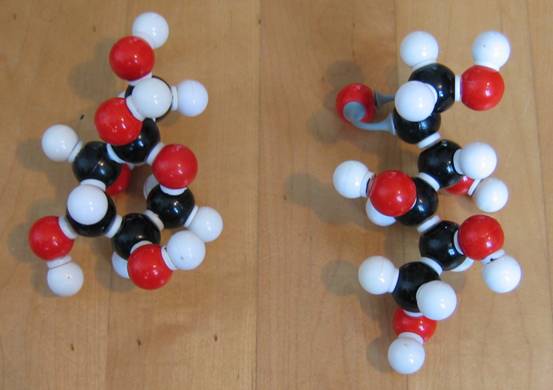
C6H12O6 C6H12O6
Schrijf de twee structuren op papier om te ontdekken dat één lineair is en de ander cyclisch. Wat is de functionele groep die wel in de lineaire, maar niet in de cyclische structuur bestaat?
Hieronder nog zo'n foto. Maar dan nu met andere modeltypes (de verbindingsstukjes zijn verschillend).
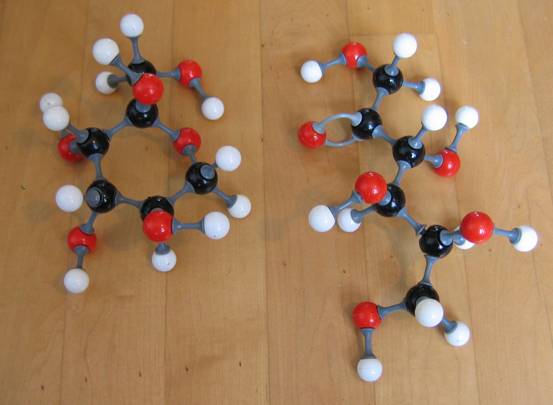
Let er op dat in het eerste modeltype de dubbele binding niet met de juiste verbindingsstukjes is na te bootsen!!
6.1 Optische isomerie
Het woord "optisch" geeft aan dat moleculen met dit type isomerie speciale eigenschappen hebben op het vlak van de optica.Elke organische stof waarvan één of meer C-atomen gekoppeld zijn aan vier verschillende atomen of atoomgroepen, hebben "optische activiteit": ze kunnen het trillingsvlak van monochromatisch licht draaien, naar links of naar rechts.
Met een polarimeter kun je deze draaiing meten. Het atoom dat zo werkt, dus gekoppeld is aan vier verschillende groepen, noemen we een '(optisch) actief centrum'.

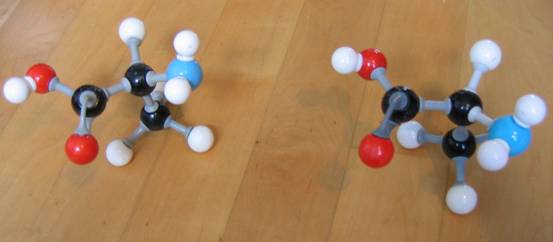
D-alanine L-alanine D-alanine D-alanine
ze zijn spiegelbeeld van elkaar ze zijn gelijk, maar niet elkaars spiegelbeeld
Opdracht 31
Probeer de twee optische isomeren van het aminozuur Alanine te bouwen met modellen en zo de optische isomerie zichtbaar te maken.
Opdracht 32
Bekijk de volgende structuren nauwkeurig:
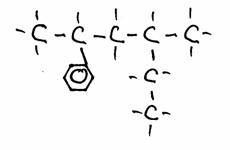 |
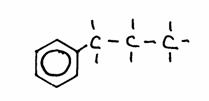 |
 |
1 |
2 |
3 |
- Geef de namen van elke structuur. Let op, misschien zijn er meerdere mogelijkheden.
- Zijn de structuren 2) en 3) isomeren? Ja of Nee?
Leg je antwoord uit.
antwoord 04-32
Meer informatie over stereochemie kun je vinden op onderstaande website: ruimtelijke structuren in de organische chemie
7. Biochemie
7.1 Inleiding
Biochemie mag niet ontbreken in een cursus over de naamgeving. Steeds duidelijker is het geworden hoe de "chemie" het lichaam en zelfs het gedrag van levende wezens, ook van de mens, beïnvloedt. Wat er al niet gebeurt in het metabolisme: alles gehoorzaamt de wetten van de scheikunde. "Het is allemaal chemie"De naamgeving in de wereld van de biochemie is niet eenvoudig, maar toch gehoorzaamt het aan de normale regels voor nomenclatuur.
We bekijken alleen de 'eenvoudige' zaken (hier gaan we niet in op het vreselijk ingewikkelde van bijvoorbeeld medicijnen):
Het menselijk lichaam is opgebouwd uit chemische stoffen die zich voortdurend bevinden in een dynamische toestand (voortdurend onderhevig aan veranderingen): ze verplaatsen zich, verdunnen of concentreren zich, reageren met andere stoffen, gaan ergens in of uit, enz.
Veel namen van deze stoffen zijn goed bekend bij het publiek, zoals koolhydraten, eiwitten en vetten.
Een scheikundige moet iets meer weten dan koolhydraten, eiwitten en vetten.: niet alleen namen maar ook structuren, eigenschappen, reacties.
Dit hoofdstuk beperkt zich tot de nomenclatuur. De rest komt later.
In het algemeen onderscheiden we vier belangrijke groepen van biochemische stoffen:
- Sachariden (koolhydraten, glyciden)
- Lipiden (oliën en vetten)
- Proteïnen (eiwitten)
- Nucleïnezuren (kernzuren) (DNA RNA)
Feitelijk valt de biochemie onder de organische chemie, maar er zijn zoveel speciale stoffen die echt behoren bij de levende organismen, in het bijzonder de macromoleculen, dat er voldoende reden is om er een aparte paragraaf aan te wijden.
Die stoffen bevinden zich in levende wezens (mensen, dieren, planten). In dit hoofdstuk bekijken we het vanuit het standpunt van de mens. structuren van vitamines, hormonen, en dus ook medicijnen, etc. blijven hier buiten beschouwing.
7.2 Koolhydraten / sachariden
Opdracht 27Het begrip "koolhydraten" is eigenlijk een verkeerd woord, historisch zo ontstaan in de natuurwetenschappen.
Leg deze bewering uit.
De sachariden kunnen we beschouwen als C-ketens met aldehyden of ketonen gecombineerd met enkele OH-groepen.
Het achtervoegsel om ze te herkennen is ....ose.
Ze dienen als reserve- en energierijk voedsel .
Mono-, di-, (oligo-) en polisachariden
Voorbeelden:- glucose en fructose
- sacharose en maltose
- amilose en cellulose in de planten, en glicogeen in de dieren
Opdracht 33
Controleer de formle C6H12O6 in het onderstaande afbeeldingen.


de cyclische structuur van glucose
- Kun je in de structuur de aldehyde-groep herkennen?
- Kun je in de structuur OH-groepen herkennen?
- Bevat de stof asymmetrische C-atomen, ofwel, is de stof optisch isomeer?
Monosachariden
Dit zijn de monomeren van de polysachariden. Er zijn diverse typen monosachariden, afhankelijk van:- het aantal C-atomen: tetrose, pentose, hexose, heptose
- de aanwezigheid van een aldehyde- of ketongroep: aldose en ketose
- de structuur van het hele molecuul, lineair of open, dan wel cyclisch of gesloten
Vijf voorbeelden van monosachariden:
Glucose α en β Galactose Fructose Ribose
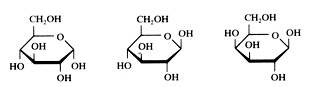
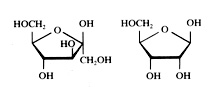
Opdracht 34
Tot welk type of typen behoort glucose?
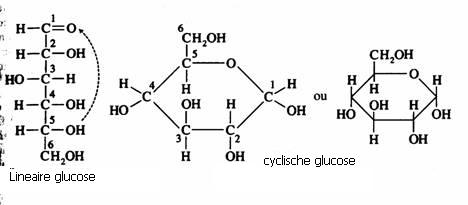
Cyclisch of lineair
Monomeren hebben - normaal gesproken - allebei de structuren, cyclisch en lineair, die voortduren met elkaar in evenwicht zijn (verondersteld dat ze opgelost zijn in water). Let erop dat de cyclische structuur de specifieke aldehyde- of ketongroep kwijt is.Wel wordt altijd de ring van de cyclische structuur gesloten door een zuurstofatoom, dat dan zich bevindt tussen twee koolstofatomen. Dit verschijnsel heeft consequenties voor de reactiviteit van de stoffen.
Disachariden
Disachariden zijn 'dimeren': samengesteld uit twee monomeren die een cyclische en een lineaire structuur kunnen hebben. De verbinding tussen deze monomeren zou je een 'zuurstofbrug' kunnen noemen: je ziet altijd de volgende binding: C - O - CVoorbeelden:
Sacharose heeft twee ringen: een van glucose en een van fructose. In het dagelijks leven noemen we dat eenvoudig: suiker.
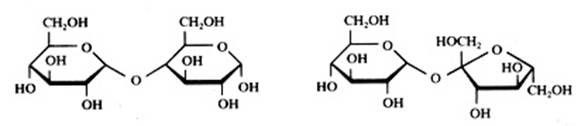
maltose en saccharose
Maltose is ook samengesteld uit twee monomeren (2 x glucose), waarvan één een linaire structuur kan hebben en de andere alleen maar cyclisch kan zijn.
Opdracht 35
Bouw een model van een suikermolecuul en schrijf de structuurformule op.
polysachariden
Honderden of duizenden monomeren, in het bijzonder glucose doet daaraan mee, zijn aan elkaar gekoppeld en vormen een zeer lange keten: een macromolecuul. In het algemeen mag je er van uitgaan dat hier de onderdelen allemaal cyclisch zijn.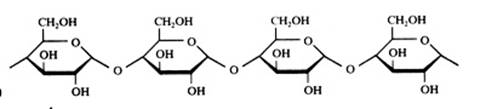
- in planten: amylose of zetmeel, en cellulose
- in mens en dier: glycogeen
Zetmeel + ion I3-
7.3 Lipiden of Vetten: glycerol & vetzuren
Als we over lipiden spreken, moeten we bedenken dat we ons beperken tot plantaardige oliën en dierlijke vetten en dat die allemaal een vergelijkbare basisstructuur hebben:tri-esters van glycerol (1,2,3-trihidroxipropaan) en vetzuren;
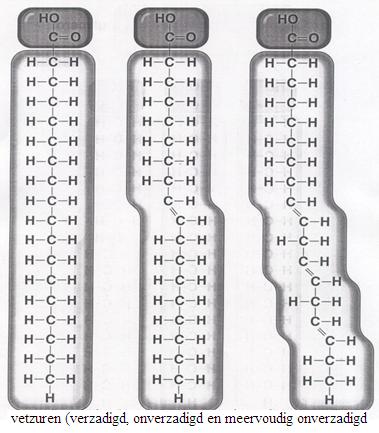
In het dagelijks leven is het verschil tussen vet en olie volkomen duidelijk (in elk geval vloeibaar en vast). Achter dit verschil gaat een chemisch verschil schuil: onverzadigde en verzadigde vetzuren. De onverzadigde stoffen zijn veel vloeibaarder (olie) en de verzadigde zijn vast (vet).


Eén molecuul glycerine verbindt zich met drie moleculen vetzuur. Ze vormen dan één molecuul lipide (vet of olie). Daarnaast ontstaan ook drie moleculen water. In het voorbeeld zal het wel om een olie gaan
Opdracht 36
Hoe kun je in het voorbeeld zien dat het product waarschijnlijk een olie zal zijn?
Opdracht 37
Leg uit of de vetzuurmoleculen polair of apolair zijn.
7.4 Proteïnen
(essentiële) aminozuren
Het woord "aminozuur" geeft al aan wat de samenstelling van deze verbindingen zal zijn:Een aminozuur bevat een aminogroep (-NH2) en een carboxylgroep (-COOH).
De eenvoudigste aminozuur is 'glycine'.
H2N - CH2 - COOH
In het tabellenboek, tabel 16, kun je alle aminozuren vinden die meedoen aan de eiwitsynthese.
Opdracht 38
Geef de officiële namen van de aminozuren Gli, Ala, Leu, Phe en Val.
Het menselijk lichaam, om eiwitten te maken, heeft vele moleculen van aminozuren nodig.
Sommige aminozuren kunnen door het lichaam zelf worden gebouwd uit andere stoffen, andere weer niet. Dié aminozuren die het lichaam zelf niet kan aanmaken, moeten dus absoluut van buiten worden aangevoerd, via het voedsel dus.
Deze worden "essentiële aminozuren" genoemd.
Peptiden
Aminozuren kunnen peptidebindingen vormen.
Doen er meerdere aminozuren mee, dan kun je een aminozuurketen krijgen, waarin elk aminozuur aan het andere is gekoppeld via een peptidebinding.
Er vormt zich dan een 'polypeptide'.
Opdracht 39
Met drie aminozuren (zie tabel XVI voor de stukturen) kun je verschillende tripeptiden maken.
Geef de structuren.
(Poli)peptiden, proteïnen of eiwitten
Opdracht 40| 1) ---- C - NH - CO - C - NH - CO - C - NH - CO - C - NH ---- |
| 2) ---- C - COO - C - C - COO - C - C - COO - C - C ----- |
| 3) ---- CNH2 - C - O - C - CNH2 - C - O - C - CNH2 - C - O ---- |
| Bewering: "structuur 1 laat de eiwitstructuur zien" |
| Is deze bewering waar of vals? |
We mogen wel aanhouden dat 'polypeptiden' in feite hetzelfde zijn als 'eiwitten' of proteïnen. Altijd gaat het om een enorm aantal aan elkaar gekoppelde aminozuren.
Niet elke polypeptide is per definitie ook een natuurlijk eiwit. Natuurlijke eiwitten hebben altijd een secundaire en een tertiaire structuur en gebruiken alleen natuurlijke aminozuren.
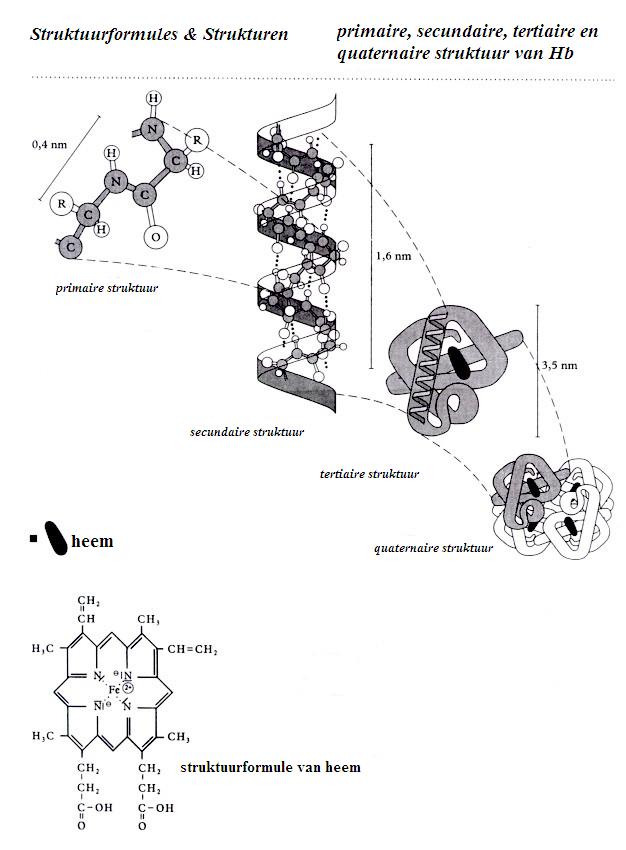
- De primaire structuur van een eiwit is de volgorde waarin al die aminozuren aan elkaar zijn gekoppeld binnen een molecuul.
- De secundaire structuur is de helix (zie figuur); een spiraalvorm van de primaire structuur.
- De tertiaire structuur is de manier waarop die helix verder is opgevouwen.
- Soms is er ook nog een kwaternaire structuur, als diverse pakketjes tertiaire structuur samenwerken.
Opdracht 41
Geef in de volgende structuren de primaire, secundaire en tertiaire structuur aan en ook de plaats van het 'Co-enzym'.
Enzymen behoren tot de groep van proteïnen (zie de biologie).
Vaak hebben de enzym-eiwitmoleculen een actieve plaats, een Co-enzym, zoals de heemgroep in het transportenzym hemoglobine (zie figuren).
7.5 DNA
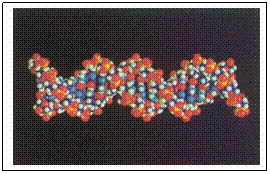
Desoxi-ribo Nucleic Acid (Engels), of in het Nederlands: Desoxy Ribo Nucleínezuur
Dat zijn de macromoleculen (en ze zijn buitengewoon macro!!) die zich in de CelKern bevinden van levende wezens. Ze zijn het belangrijkste deel van de chromosomen en dragen dus op een chemische manier (erfelijke) informatie nodig voor het functioneren van de cel.
Voornamelijk de vorming van eiwitten wordt op die manier gereguleerd.
In rustvorm hebben de DNA-moleculen een spiraalvorm, een zgn. dubbele helix. (zie foto boven)
Opdracht 42
Leg uit wat de volgende bewering wil zeggen: De DNA-moleculen zijn co-polymeren van 4 monomeren, waarbij elke monomeer wordt voorgesteld door een symbool:
A, G, T en C.
Adenosin, Thymine, Guanine en Cytosine zijn de nucleïnezuren, kernzuren, die aan een soort DNA-ruggegraat verbonden zijn.
Die ruggegraat is een lange keten van afwisselend een ribosegroep en een fosfaatgroep.
De primaire structuur van DNA kun je beschouwen als de volgorde van de nucleïnezuren, net als de aminozuren bij de eiwitten.
Ook net als bij de eiwitten is er een secundaire structuur: een helix-structuur (spiraalvormig). DNA heeft zelfs een "dubbele helix", d.w.z. dat het molecuul dubbel is.
De twee zijn een soort spiegelbeeld van elkaar. Als ze uit elkaar gaan vormen zich twee gelijkwaardige DNA-strengen.
Bij zijn functioneren als regelneef voor de cel, stuurt het DNA informatie uit de kern naar het plasma, in de vorm van RNA (er wordt van van bepaalde stukken DNA een copy gemaakt)
8. Benzeen en benzeenderivaten
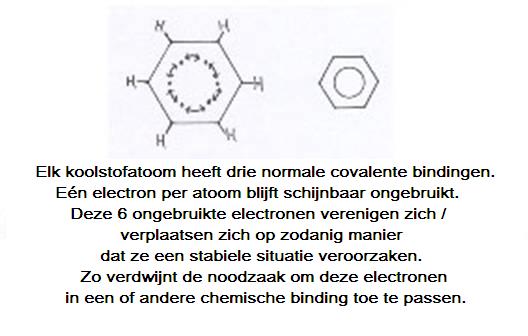
Hoe kun je de structuur van benzeen benaderen, bekijken? Een makkelijke manier is om uit te gaan van de vier valentie-elektronen van het koolstofatoom.De benzeenring kun je opvatten als opgebouwd uit zes koolstofatomen, die elk drie van hun valentie-elektronen gebruiken voor bindingen met één H en twee buur-C's.
Laat orbitalen en hybriden (spx) heel even buiten beschouwing; dat komt zo.
Dan is er dus van elk koolstofatoom nog één valentie-elektron ongebruikt, over; het is nog vrij.
Wat doen die in totaal zes vrije elektronen vervolgens? die vormen tezamen een soort ring-binding, van de gezamenlijke zes C-atomen. Er is dus een bijzondere binding die we in de structuren aangeven met een cirkel.
Op die manier is er tussen elk C-atoom precies dezelfde binding. Dit is wel een wat simpele weergave.
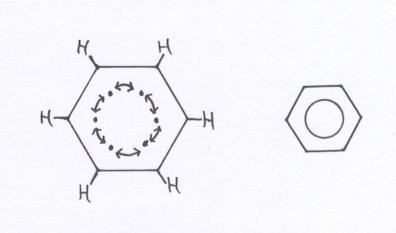
In de betere scheikundeboeken kun je veel meer uitleg vinden, preciezer, met de orbitalen 2s, 2px, 2py en 2pz.
Die drie orbitalen van C in het benzeen: 2s en 2px en 2py kunnen mengen, en vormen dan drie nieuwe "hybride"-orbitalen: drie orbitalen sp2.
Deze zijn verantwoordelijk voor het aangaan van drie verbindingen (we spreken van orbitaal-overlapping: twee met andere koolstofatomen en één binding met een waterstofatoom van het type σ.
Tussen elke twee koolstofatomen blijft nog een overlapping (binding) van 2pz-orbitalen over. Oftewel: in totaal zes bindingen van het type π.
Voor de naamgeving van benzeenderivaten kiezen we één van de zes C-atomen in de ring. Die noemen we dan nummer 1.
En de andere, vanaf deze, hebben dan de nummers 2 - 6
Opdracht 43
-
Geef de structuren van
- 1.2-dinitrobenzeen
- 3-amino, nitrobenzeen
- Leg je antwoord uit.
Vroeger, en nog steeds wel in veel boeken, gebruikten we voorvoegsels die tegenwoordig met nummers (1 - 6) worden aangegeven.
Een voorbeeld: 1,2 dinitrobenzeen heette vroeger (en vaak nog wel): orto-dinitrobenzeen (orto = 1,2)
- Orto = 1,2
- Meta = 1,3
- Para = 1,4
Opdracht 44
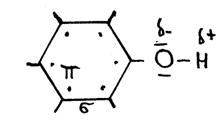
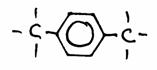
Bovenstaande structuur (C6H5OH) is de structuur van "fenol".
- Wat is de officiële naam?
- Leg elk symbool uit in het schema.
- Geef een eenvoudiger structuur.
Het volgende kan lastig zijn bij de naamgeving: fenol en fenyl; voorzichtig dus; ze zijn niet hetzelfde!
Fenol heeft een OH-groep aan een benzeenring. maar als benzeen zelf als zijketen optreedt, dan heeft ie "fenyl".