IJzer(s) + Koper(II)sulfaat(aq)
is een redoxreactie.
|
3. Indirecte Redoxreacties; |
|


| De vergelijking van koppel 1: | red 1 | ox 1 + elektronen | |
| vergelijking van koppel 2: | ox 2 + elektronen | red 2 | |
| Totaalvergelijking: | red 1 + ox 2 | ox 1 + red 2 |
| De vergelijking van koppel 1: | Al | Al3+ + 3e- | | x 2 | |
| vergelijking van koppel 2: | I2 + 2e- | 2I- | | x 3 | |
| Totaalvergelijking: | 2Al + 3I2 | |
2Al3+ + 6I- |
| koppel 1: | red 1 | ox 1 + elektronen | |
| koppel 2: | ox 2 + elektronen | red 2 | |
| Totaalvergelijking: | red 1 + ox 2 | ox 1 + red 2 |



| N2 | is het normale stikstofgas, kleurloos en reukloos |
| NO + NO2 | de 'nitreuze dampen', geelbruin, verstikkend |
| N2O | een kleurloos gas, eigenlijk een soort zenuwgas.
Het veroorzaakt lachstuipen en helpt om mensen te verdoven. Het werd uitgevonden in 1860 en toegepast, bijvoorbeeld door tandartsen. |


| Oxidator | Reductor | |
| H2O2+ 2H+ + 2e- | 2H2O | |
| O2 + 2H+ + 2e- | H2O2 |
| oxidatoren | reductoren | |
| Cu+ + e- | Cu | |
| Cu2+ +2e- | Cu | |
| Cu2+ + e- | Cu+ |
| Oxidatoren | reductoren | |
| PbO2(s) + SO42-+ 4H+ + 2e- | PbSO4(s) + 2 H2O | |
| Pb2++2e- | Pb(s) | |
| PbSO4(s)+2e- | Pb(s) + SO42- |
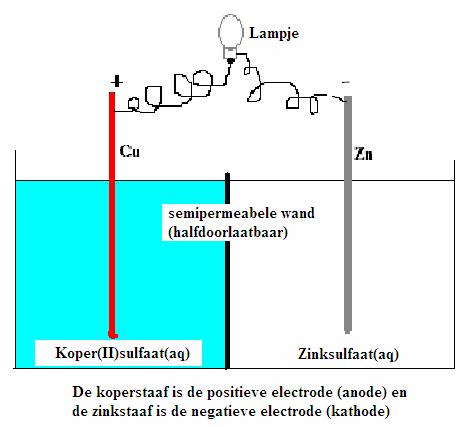

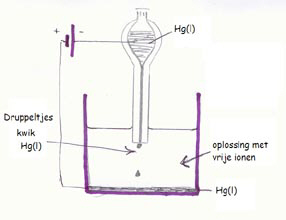
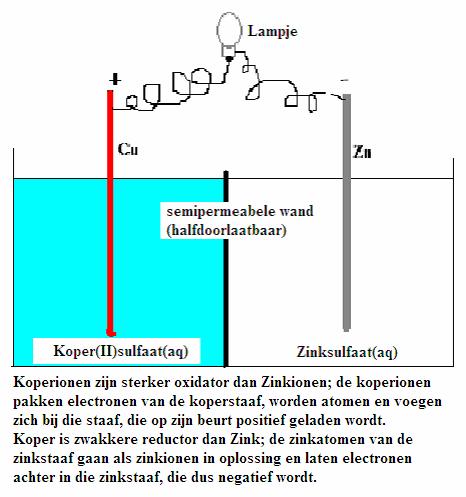
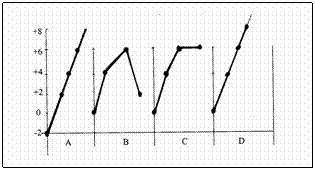
| Direct | Indirect | |
| sterk | spontane reacties |
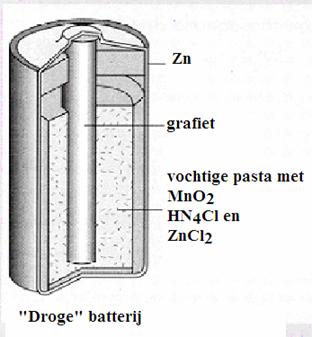
batterijen & accu's
aan het werk |
| zwak |
er gebeurt niets
effectiefs |
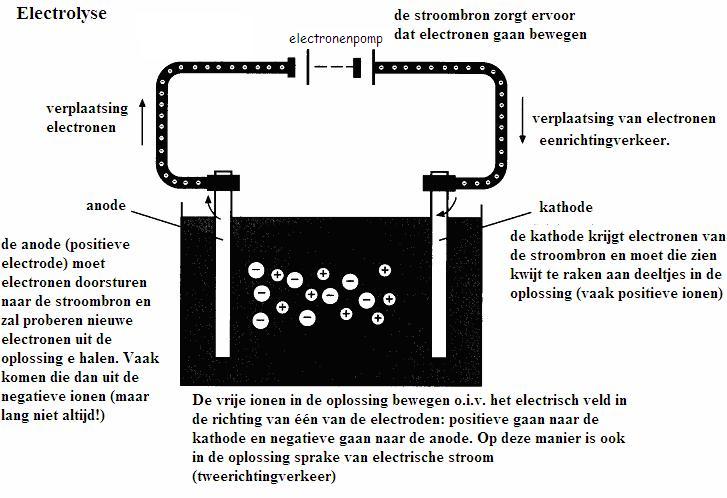
elektrolyse en
opladen van batterijen en accu's |
| Zonder elektroden | Met elektroden | |
| 1. maak een schets van wat er allemaal gebeurt / gedaan wordt. | ||
|
2a. Maak een lijst van alle aanwezige stoffen / deeltjes, inclusief elektroden)
2b. Geef aan wat de reductor en wat de oxidator is(onderstrepen) |
||
| 3. geef de halfreactievergelijkingen |
3. geef de halfreactievergelijkingen
OX reageert aan de positieve elektrode RED reageert aan de negatieve elektrode |
|
| 4. kloppend maken en totaalvergelijking | 4. kloppend maken van elektrodereacties | |
| 5. noteer eventuele volgreacties | ||
| 6. Noteer waarnemingen en conclusies | ||
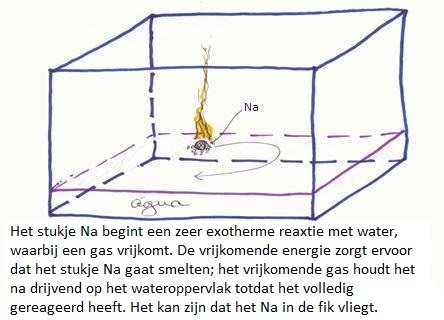
| Red: | Na | Na+ + e- | |x2 | |
| Ox: | 2H2O + 2e- | H2 + 2OH- | |x1 |
 2Na+ + H2 + 2OH-
2Na+ + H2 + 2OH-