|
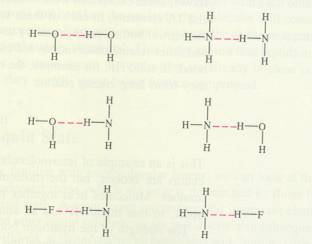
Je weet dat alle stoffen zijn opgebouwd uit deeltjes, en de eenvoudigste deeltjes zijn atomen of ionen.
Deze deeltjes - normaal gesproken - bestaan niet in hun eentje, blijven niet alleen, maar hebben zich meestal verbonden aan andere deeltjes. Dat kan op verschillende manieren gebeuren, maar altijd zitten ze met hun buitenkanten tegen elkaar, dus het heeft met de valentie-elektronen in de buitenste elektronenschil te maken. Alleen de atomen van edelgassen kunnen 'vrijgezel' blijven. Die verbinden zich zomaar niet met andere deeltjes. Elke manier om deeltjes aan elkaar te binden noemen we een chemische binding. Daarvan bespreken we in dit hoofdstuk de drie belangrijkste. Wat dan het resultaat is van zo'n chemische binding heeft grote gevolgen voor de eigenschappen van de gevormde stof. |
De ION-binding = aantrekking tussen positieve en negatieve deeltjes. |
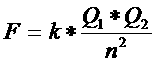
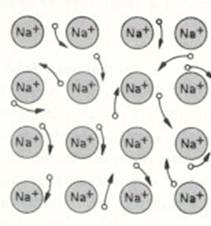
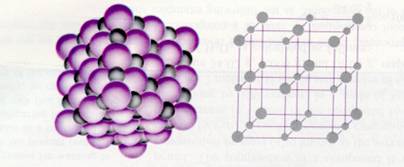
Metaalbinding =
|
|
Opdracht 6 is een actie-opdracht
[een actie-opdracht moet je in groepjes proberen op te lossen. Soms zijn er opdrachten bij die je als praktikum kunt uitvoeren] Je doet een aantal (8) opdrachten volgens een vast patroon van (tien) vragen (de vragenlijst). Je krijgt eerst een voorbeeld(reactie van ijzer met zwavel). Met dat voorbeeld bespreken we eerst al die vragen, zodat je bij de 8 opdrachten weet wat je moet doen. Het is niet de bedoeling dat je de reacties ook zelf echt doet. Het blijft dus theorie, papierwerk.
De vraag is elke keer of de twee stoffen met elkaar reageren en, zo ja, wat je dan kunt weten over de chemische binding tussen die twee. Elke reactie moet je bestuderen aan de hand van de vragenlijst hieronder.
|
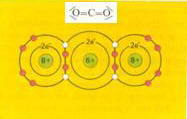
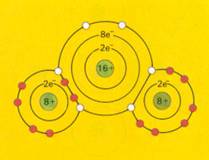
Covalente bindingen = gemeenschappelijk gebruik van elkaars elektronen door twee atomen |



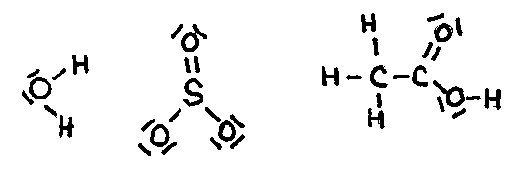
| mono | 1 | di | 2 | tri | 3 | tetra | 4 | penta | 5 |
| hexa | 6 | hepta | 7 | okta | 8 | nona | 9 | deka | 10 |
| CO | (mono)kool(stof)mon(o)oxide |
| CO2 | (mono)kool(stof)dioxide |
| P2O5 | (di)fosforpentaoxide |
| P2O3 | (di)fosfortrioxide |
| N2O | NO | N2O3 | CuCl | PbS | SO2 |
| I | II | III | IV | V | VI | VII | VIII | |
| 1 | H | He | ||||||
| 2 | Li | Be | B | C | N | O | F | Ne |
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar |
| 4 | K | Ca | Ga | Ge | As | Se | Br | Kr |
| 5 | Rb | Rb | In | Sn | Sb | Te | I | Xe |
| 6 | Cs | Bi | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra |
| Metalen | Cs |
| Metalloiden | Po |
| niet-metalen | Se |
| Metaalbindingen | veel metalen hebben een lage E |
| Ionbindingen | ΔE: > ±1,6 |
|
Covalente bindingen
- covalent, niet polair - covalent, polair |
0 < ΔE < ±1,6
0 < ΔE: < ±0,4 ΔE: > ±0,4 |

| CS2 (ΔE = ±0) | CO2 (ΔE = ±1.0) | H2O (ΔE = ±1.3) |
| Covalente bindingen | Covalente bindingen | Covalente bindingen |
| Niet polaire moleculen | Niet polaire moleculen | Polaire moleculen |
| Er is geen dipool | Er is geen dipool | Dipool |
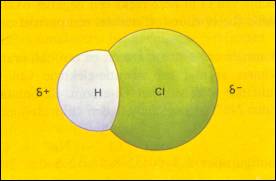
| Er zijn geen δ+ en δ- |
Er zijn δ+ en δ- waarvan de zwaartepunten elkaar overlappen |
De zwaartepunten van δ+ en δ- overlappen elkaar niet (bevinden zich op afstand van elkaar) |
|
S=C=S
|
O = C = O
δ- δ+ δ- |
δ+
δ+
H H \ / O δ- |


| enkelvoudig: | Na+ Cl- H+ |
| samengesteld: | H3O+ OH CO32- |
H-H |
- 4,36 | H-F |
- 5,63 | N≡N |
- 9,45 | C-F |
- 4,4 |
F-F |
- 1,53 | H-Cl |
- 4,32 | C≡C |
- 8,3 | C-Cl |
- 3,3 |
Cl-Cl |
- 2,43 | H-Br |
- 3,66 | C≡N |
- 8,9 | C-Br |
- 2,8 |
Br-Br |
- 1,93 | H-I |
- 2,99 | C=O |
- 8,0 | C-I |
- 2,4 |
I-I |
- 1,51 | H-O |
- 4,646 | C=S |
- 2,6 | C-O |
- 3,5 |
H-O (alkanol) |
- 4,5 | N-H |
- 3,9 | C=C |
- 6,1 | H-S |
- 3,44 |
C-C |
- 3,5 | C-H |
- 4,1 | O=O |
- 4,98 | P-H |
- 3,22 |
|
Opdracht 28 is een actie-opdracht:
[een actie-opdracht moet je in groepjes proberen op te lossen. Soms zijn er opdrachten bij die je als praktikum kunt uitvoeren] Onderstaande reacties ben je al eerder tegen gekomen. De bedoeling is dat je elke reactie behandelt volgens de vragenlijst met de zes vragen.
|