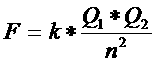|
Het chemisch element is een stof die met chemische middelen
niet meer verder te ontleden is in andere stoffen. |
| Elk element heeft een eigen atoomnummer en een eigen symbool |
| Elk symbool is een hoofdletter, vaak maar niet altijd met een kleine letter |
|
Het aantal hoofdschillen kan variëren van 1 tot 7, wat overeenkomt met de zeven perioden van het PS (de horizontale rijen) |
Het aantal valentie-elektronen kan variëren van 1 tot 8, wat overeenkomt met het aantal hoofdgroepen van het PS (de vertikale kolommen) |
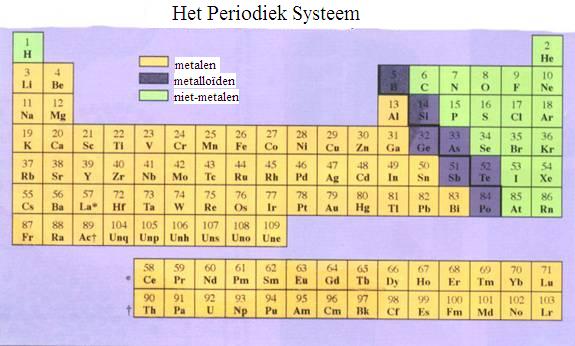
| I | II | III | IV | V | VI | VII | VIII | |
| 1 | H | He | ||||||
| 2 | Li | Be | B | C | N | O | F | Ne |
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar |
| 4 | K | Ca | Ga | Ge | As | Se | Br | Kr |
| 5 | Rb | Rb | In | Sn | Sb | Te | I | Xe |
| 6 | Cs | Bi | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra |
| Metalen | Cs |
| Metalloiden | Po |
| niet-metalen | Se |
|
halo- geen |
symbool | atoom- nummer |
atoom- massa |
dichtheid in g/cm3 |
smeltpunt in K |
kookpunt in K |
kleur |
| fluor | F2 |
9 |
19,0 |
1,11 |
53 |
85 |
geel |
| chloor | Cl2 |
17 |
35,5 |
1,56 |
172 |
239 |
Geelgroen(g) |
| broom | Br2 |
35 |
79,9 |
3,12 |
266 |
331 |
roodbruin(l) |
| jood /jodium |
I2 |
53 |
126,9 |
4,94 |
387 |
456 |
Zwart(s) |
| elektronegativiteit is de neiging van een (neutraal) atoom om negatieve lading (elektronen) aan te trekken. |