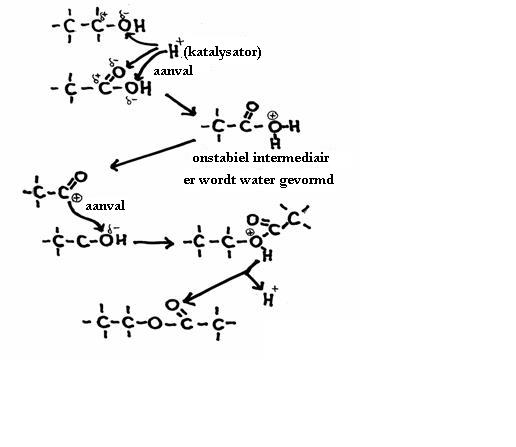
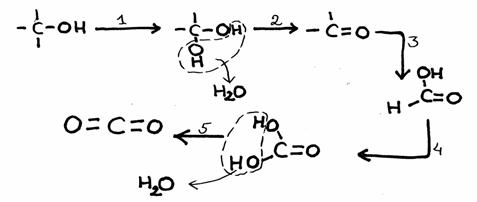
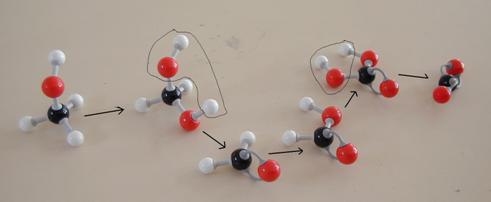
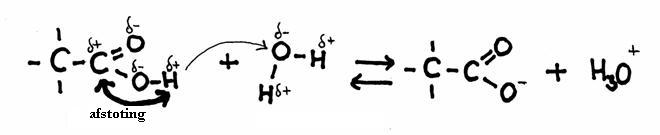
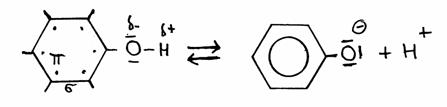
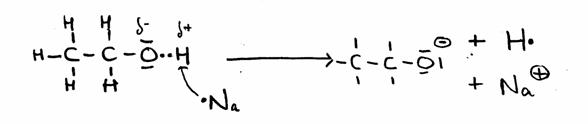
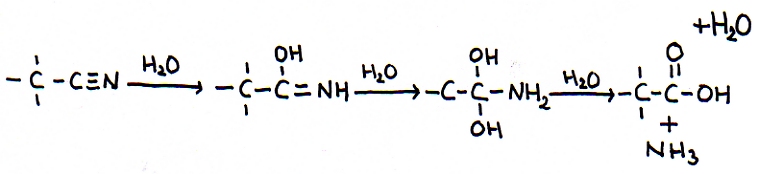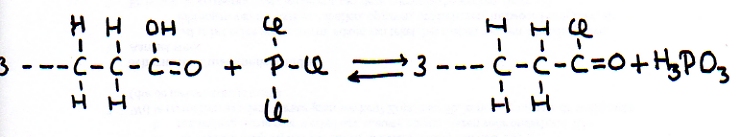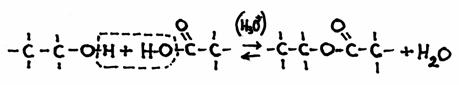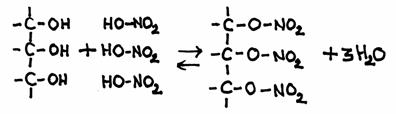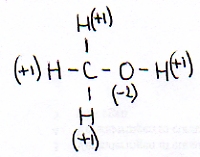De andere kant blijft nog open en klaar om zelf weer de aanval voort te zetten op een ander molecuul van hetzelfde type:
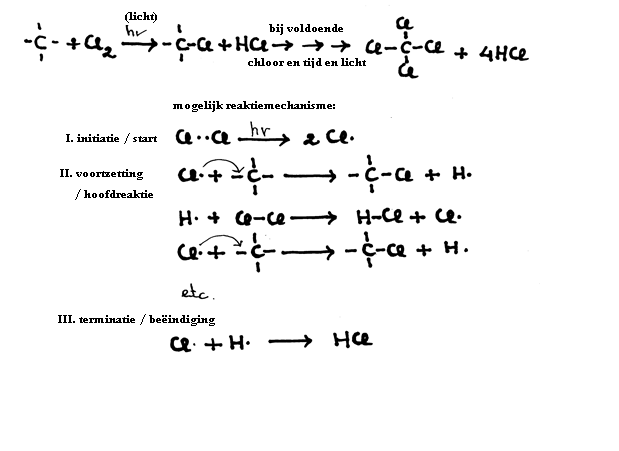
Dit is de initiatie (zie ook de initiatie van eenvoudige substitutie):
Cl – Cl
Cl· + CH2 = CH – CH3
Deze radikaal valt aan op de moleculen die in overmaat aanwezig zijn; dat zijn de andere moleculen van propeen:
- C3H6Cl· + C3H6
 C6H12·
C6H12·
- C6H12· + C3H6
 C9H18·
C9H18·
- enzovoort
Het is een kettingreactie die enorm lange ketens veroorzaakt. Elke keer vormt zich een groter radikaal dat elke keer weer opnieuw een monomeer kan vangen. Op die manier ontstaan makromoleculen.
Die twee elektronen vormen meteen een normale (covalente) binding, de actie is over en de polymerisatie komt ten einde.
Er zijn verschillende manieren om zo'n kettingreactie af te sluiten:
Terminatie: CnH2n· + Cl·
of:
CnH2n· + CnH2n·