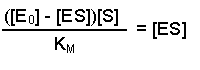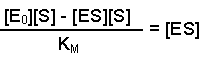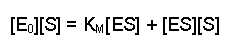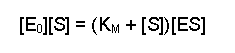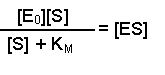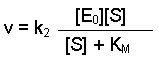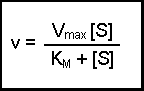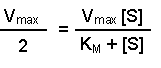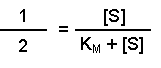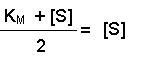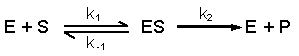(hidrólise
|
5b. A especificidade das enzimas 5d. Outras propriedades das proteínas |
|
| Os aminoácidos servem - na maior parte - para sintetizar lípidos; | V / F |
| Há 10 aminoácidos essenciais para o homem; | V / F |
| Todos os aminoácidos têm um carácter anfotérico | V / F |
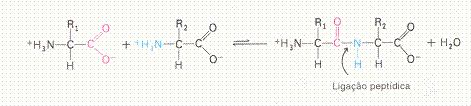
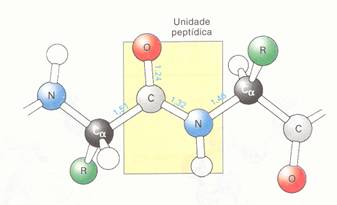


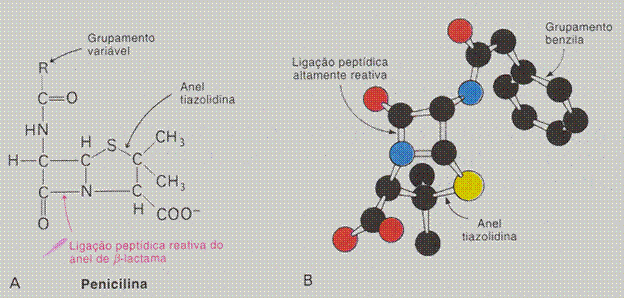
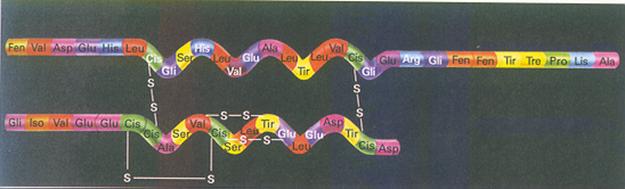
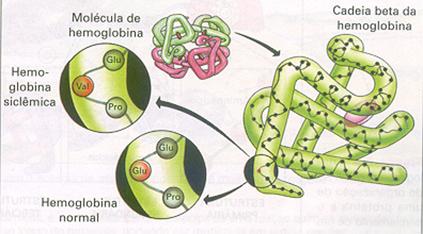
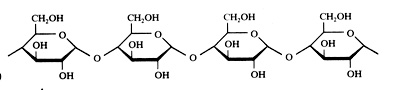
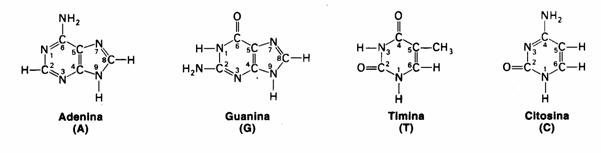
| Proteínas são polímeros; | V / F |
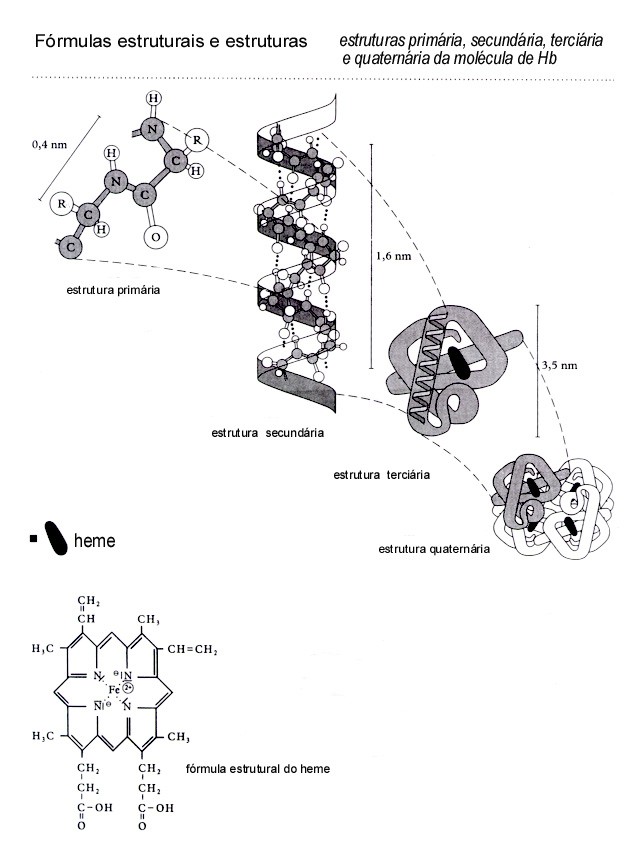
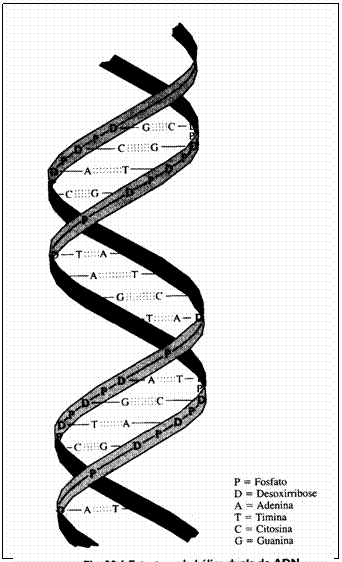
| Proteínas têm uma estrutura primária, i.é. a sequência dos aminoácidos; | V / F |
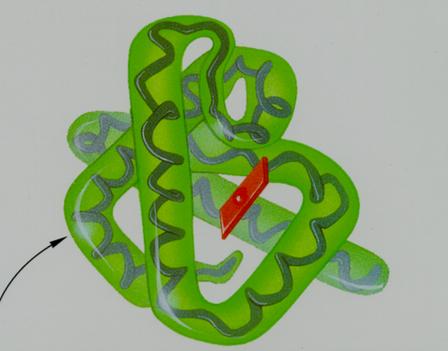
| Uma estrutura secundária liga várias estruturas primárias; | V / F |
| Uma estrutura terciária é um hélice (hélix); | V / F |
| A estrutura secundária e terciária deve sua estabilidade a ligações/pontes de H e S | V / F |
| Proteínas podem ser desnaturadas (reversível ou irreversívelmente), implicando a sua destruição completa com álcool, com ácido, mas não com aquecimento; | V / F |
|
A estrutura primária não sofre desnaturação; só pode ser destruída num processo químico
(hidrólise |
V / F |
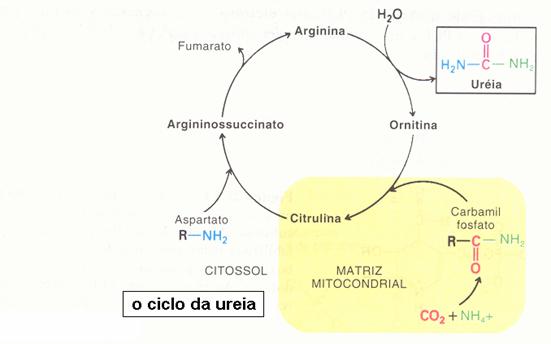
| Existem proteínas estruturais (exemplo: albumina) e proteínas enzimáticas (exemplo: oxidase) | V / F |

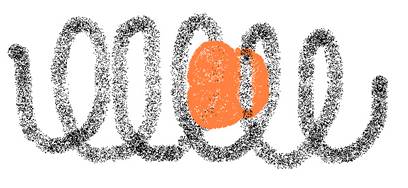 ou
ou




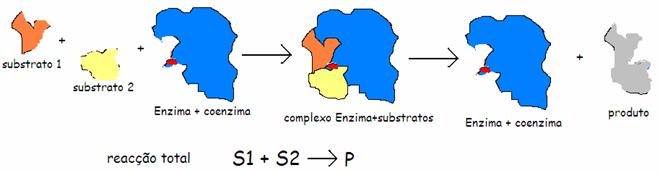

| Oxidoreductases | catalisam reacções redox (ex. glucose-oxidase) |
| Transferases | transferem grupos funcionais dum doador para um aceitador. |
| Hidrolases | separar moléculas (ex. peptidases, proteases) |
| Liases | tiram ou juntam certos grupos funcionais (ex. decarboxilase) |
| Isomerases | mudam isómeros (mutase) |
| Ligases | para ligar moléculas (piruvatocarboxilase) |
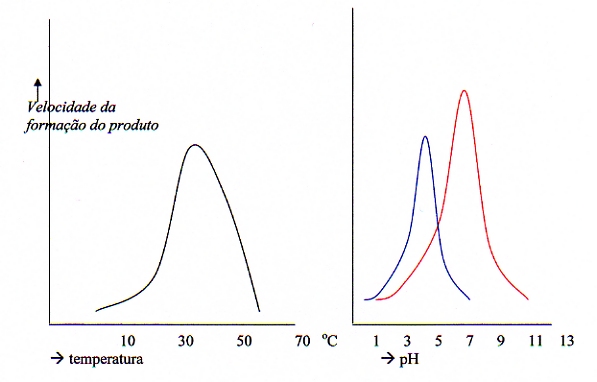
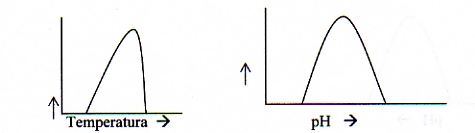
| Pepsina | 1,5 | no estômago |
| Amilase | 6,6 | na saliva |
| Lipase | 8,0 resp. 7,0 | no pâncreas resp. no intestino |
| Sacarase | 7,0 | no estômago |
| sítio | enzimas | pH-óptimo |
| Na saliva | amilase e maltase | 6,6 |
| No estômago | peptase, rennase | 1,5 - 4 |
| No pâncreas | amilase, maltase, lipasse, tryptase, polipeptidase | 6,6 - 9 |
| Nos intestinos | maltase, sacarase, lactase, ereptase | 6,6 - 8,5 |
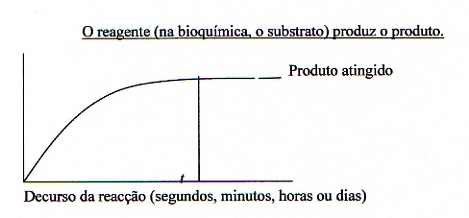
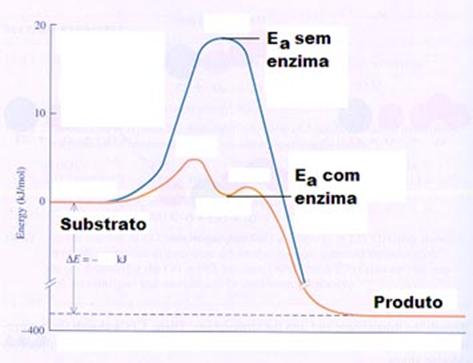
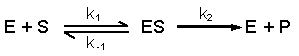

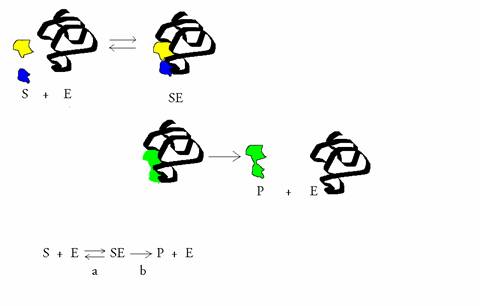
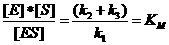
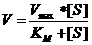
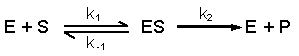
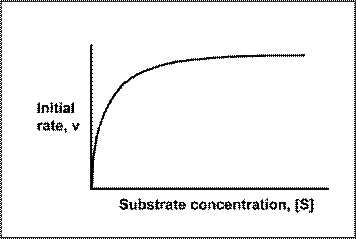
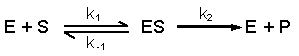
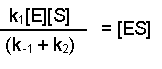
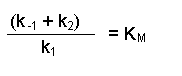
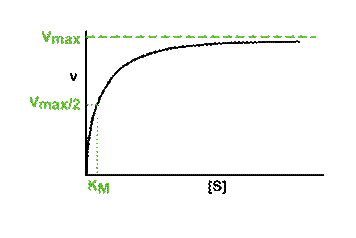
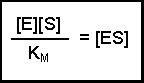 (Equation 2)
(Equation 2)