| a partícula mais pequena da substância | (a partícula que já não pode ser cortada = a-tomos). |
| Quanto mais afastado do núcleo,
tanto mais energia tem o próprio electrão. |
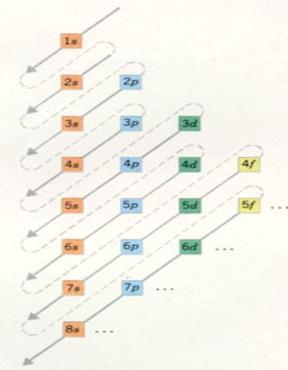
| Camada 1 é constituída por um subnível, |
tipo s | com número máximo de electrões: |
2 |
| Camada 2 divide-se em duas subníveis |
tipo s p |
com números máximos de electrões: |
2 6 |
| Camada 3 divide-se em três subníveis |
tipo s p d |
com números máximos de electrões: |
2 6 10 |
| Camada 4 divide-se em quatro subníveis |
tipo s p d f |
com números máximos de electrões: |
2, 6 , 10, 14 |
|
Camadas 5 - 7 teoricamente podiam dividir-se em 5 até 7 subníveis, mas átomos tão grandes não existem |
|||
| Camada 5 divide-se em quatro subníveis |
tipo s p d f |
com números máximos de electrões: |
2, 6, 10, 14 |
| Camada 6 divide-se em três subníveis |
tipo s p d |
com números máximos de electrões: |
2, 6, 10 |
| Camada 7 divide-se em dois subníveis |
tipo s p |
com números máximos de electrões: |
2 6 |

| Chama-se a energia de ionização a energia necessária para tirar completamente um electrão do átomo. |
| partícula | Massa (g) | Massa (u.m.a) | Carga |
| Electrão | 9,1*10-28 | 0 | -1 |
| Neutrão | 1,67495*10-24 | 1 | 0 |
| Protão | 1,67254*10-24 | 1 | +1 |
| A unidade de qualquer massa do átomo = u.m.a. |
| Sódio | Amarelo | Cobre | Verde | |
| Potássio | Violeta fraco | Estanho | Azul | |
| Cálcio | Vermelho | Chumbo | Azul fraco |