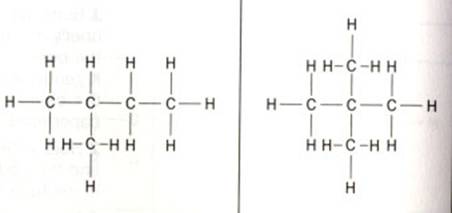
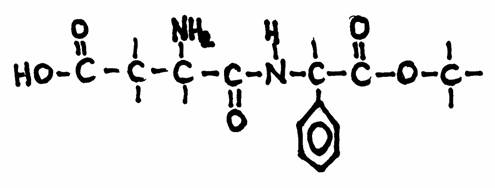
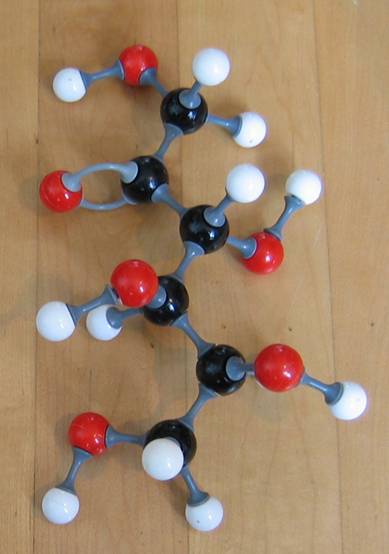
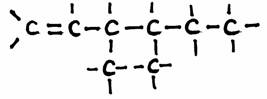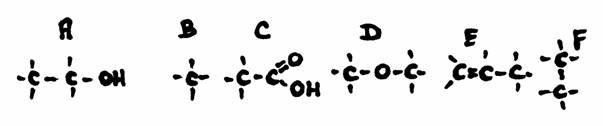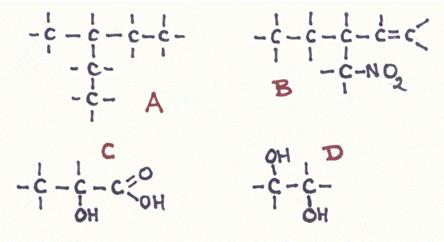Contêm um ou mais grupos carboxílicos (-COOH)
Conhecemos em particular: ácido carbónico, ácido gordo, aminoácido, fenol.
O grupo carboxílico pode ceder um ião H+, portanto, é ácido (fraco).
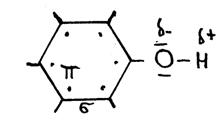
O grupo OH normalmente não cede H+, só que no caso de estar ligado a benzeno.
Para obter mais informação sobre estes ácidos, veja o capítulo sobre o assunto.
São os ácidos não-orgánicos que contêm o elemento Oxigénio.
De modo geral são formados a partir do óxido (veja parte II)
Dependente do número mínimo e máximo de átomos de Oxigénio na molécula (o que está ligado com o número de oxidação), as moléculas adoptam vários nomes e assim também as bases conjugados (iões) destes ácidos:
Exemplo:
ácido fosfórico = H3PO4. (formado a partir de P2O5 com H2O) e
ácido fosforoso = H3PO3. (formado a partir de P2O3 com H2O)
| Ácido | exemplo | Anião | exemplo |
| ácido hipo ---oso | ácido hipocloroso, HClO | hipo ---ito | hipoclorito, ClO- |
| ácido ---oso | ácido cloroso, HClO2 | ---ito | clorito, ClO2- |
| ácido& ---ico | ácido clórico, HClO3 | .....ato | clorato, ClO3- |
| ácido hiper ---ico | ácido (hi)perclórico, HClO4 | hiper ---ato | (hi)perclorato, ClO4- |
Nem todos os ácidos têm as quatro possibilidades:
- Todos têm ---ico e ---ato que são as formas mais gerais.
- Alguns têm ---oso e ---ito
- hipo--- e hiper--- são mais raros.
O melhor conhecido deste tipo é o ácido clorídrico: HCl.
A fórmula começa com H que, de modo geral, está ligado a somente um outro elemento, sem presença de Oxigénio. (HBr, HI, HCN, etc.)
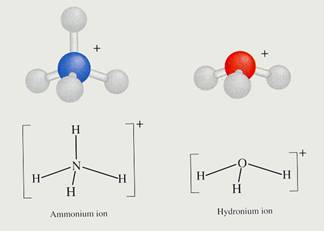
O exemplo mais famoso é o ião amónio. NH4+ pode ceder um ião H+, portanto, é um ácido de acordo com a definição.
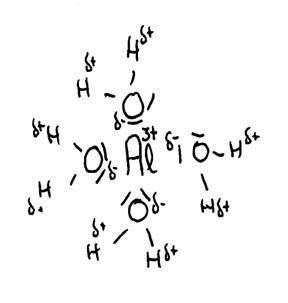
Mas existem outros, por exemplo: Al(H2O)63+.
Falamos aqui dos iões multipositivos dos metais: Al3+ , Cu2+, Fe2+ ou Fe3+, e outros. Estes iões positivos atraem, em meio aquoso, os lados negativos das moléculas de água, criando uma repulsão aos átomos de Hidrogénio (que têm uma carga δ+). Isto cria a possibilidade real de cedência de H+.
Uma solução, por exemplo, de cloreto de Ferro(III) pode obter um meio bastante ácido.
O desenho em cima mostra a atracção entre o Al3+ e a parte δ- de Oxigénio, e a parte δ+ de Hidrogénio.
As moléculas de água (em total 6) arredondam o ião 3+ do Alumínio.
Assim a distância entre 3+ e δ+ torna-se pouca, com a consequência de repulsão:
Exercício 9
Explique o carácter ácido do ião amónio, apenas com uma equação da reacção.
resposta
De modo geral, iões negativos preferem apresentar um carácter básico, mas existem certos iões negativos que podem servir de ácido, i.é, podem ceder H+.
Por exemplo: HCO3-.
Exercício 10
Os iões negativos que podem servir de ácido são anfotéricos (podem servir de ácido e de base).
Explique apenas com uma equação da reacção.