Quando quisermos resolver reacções redox, não com números de oxidação, mas com semi-equações,
temos que respeitar algumas regras:
- De que reacção se trata?
- Quais as partículas participantes?
- Quais as semi-equações?
- Qual a equação total?
- Quais as observações e quais as conclusões que podemos tirar?
6 passos sempre temos que seguir na resolução das reacções redox,
às vezes dependente do carácter directo (sem eléctrodos) ou indirecto (com eléctrodos)
|
sem eléctdodos
|
com eléctrodos
|
|
1. faça um esboço de tudo que acontece, do que é feito
|
|
2a. elabora uma lista das substâncias presentes / partículas, incluíndo os eléctrodos
2b. indica (sublinar) o próprio redutor e o próprio oxidante
|
|
|
3. dá as semi-equações
|
3. dá as semi-equações
OX reage ao eléctrodo positivo
RED reage ao eléctrodo negativo
|
|
4. acertar a reacção total
|
4. acertar as reacções aos eléctrodos
|
|
5. anotar evenuais reacções secundárias
|
|
|
6. anotar as observações e conclusões
|
|
Exemplo:
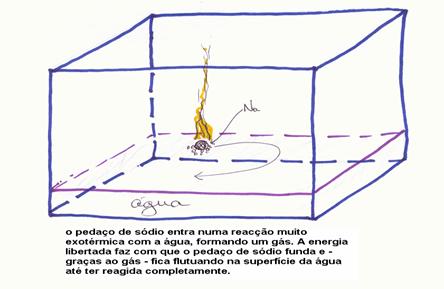
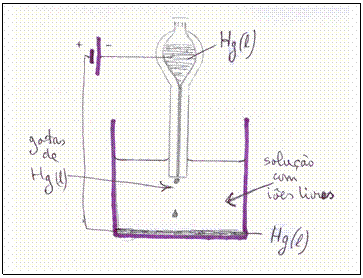
No laboratório químico colocamos um pequeno pedaço do metal Sódio em água destilada.
Tiramos o sódio dum recipiente cheio de petróleo com uma pincela. Com uma faca bem seca cortamos o pedaço de sódio para logo introduzir na água que se encontra num aquário.
Logo observamos uma reacção violente: forma-se um gás, o pedaço de sódio começa a mover (flutuar) na superfície da água e pode acontecer que se formam chamas amarelas.
O processo continua até acabar todo metal.
Umas gotas de indicador indicam ao fim um carácter básico da água.
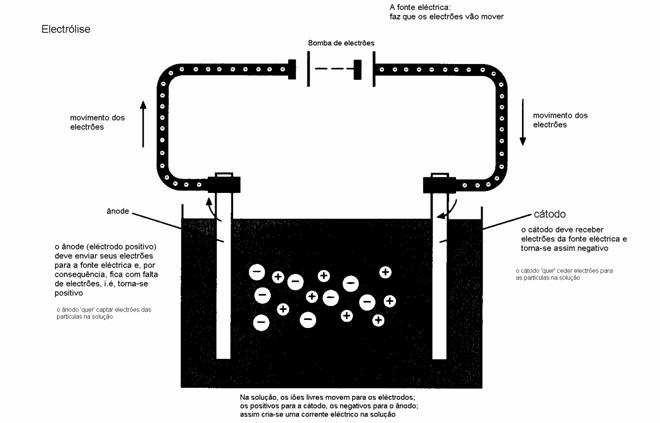
Aqui se trata duma reacção directa: as partículas de sódio chocam directamente com as partículas da água; não há eléctrodos.
1.
O esboço seguinte mostra mais ou menos a situação:
2a+2b.
As partículas presentes neste caso são apenas dois: Na e H
2O; mais nada.
Consultando a tabela podemos concluir que a água pode reagir como oxidante fraco ou como redutor fraco. Uma vez que o sódio é um redutor forte, a água só pode reagir aqui como oxidante. O metal sódio é redutor tão forte que acontece uma reacção espontânea com água, mesmo sabendo que água é bastante fraca. Mesmo sem tabela pode-se saber que o sódio será um redutor: todos os metais neutros podem ceder electrões. Na lista dos metais, o sódio é um dos metais mais reactivos.
3.
As semi-equações são: Red: Na

Na
+ + e
- |x2
Ox: 2H
2O + 2e
- 
H
2 + 2OH
- | x 1
NB: o número de electrões transferidos deve ser o mesmo em cada semi-equação.
4.
A reacção total: 2Na + 2H
2O

2Na
+ + H
2 + 2OH
-
Ou: 2Na(s) + 2H
2O(l)

2NaOH(aq) + H
2(g) ΔH < 0
5.
Provavelmente não há reacções secundárias; pode acontecer que o gás hidrogénio começa a reagir com o oxigénio no ar (chama)
6.
Observações e conclusões:
-
A reacção é espontânea, liberta-se energia
de calor e de luz, portanto, é exotérmica;
-
Forma-se o gás hidrogénio, que é muito inflamável
e acende facilmente com a energia da reacção; isto vê-se nas chamas;
-
O produto NaOH cria um meio básico (iões OH-);
a confirmar com um indicador.
Exercício 47
Em seguida 6 reacções redox para resolver de acordo com as 6 regras do esquema.
- Cálcio(s) com água(l)
- Cobre)s) com ácido nítrico concentrado
- Permanganato de Potássio(aq) com ácido oxálico(aq) (na presença de ácido sulfúrico diluído)
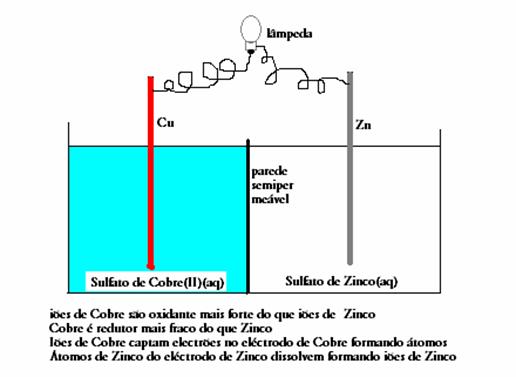
- Cobre(s) com Sulfato de Zinco(aq)
- Bromo(aq) com Iodeto de Potássio)aq)
- Permanganto de Potássio(aq) com Sulfito de Sódio(aq)
Cada vez responde às 6 regras:
- Quais as partículas presentes
-
Sublinhar a partícula oxidante mais forte e a partícula redutor mais forte. São eles que reagem.
Aconselha-se descrever os nomes, fórmulas e aparência das substâncias que contêm estas partículas
- Dá as duas semi-reacções
-
Dá a reacção total no caso de uma reacção directa; acertar tudo; investigue o equilíbrio: para que lado desloca-se?
Portanto, haverá uma reacção? Caso não, pode parar.
- Pensa bem sobre eventuais reacções secundárias
- Quais as observações e conclusões
Exercício 48
- Quais as observações durante a reacção de Potássio com água?
- Esta reacção será mais ou menos violente, comparada com a de Sódio?
Neste módulo não vamos tratar em pormenor muitas aplicações porque haverá um módulo aparte para tal.
Mas uns exemplos de aplicações das reacções redox mostramos já aqui:
- soprar em caso de controle pelo trâfico
- fotografia preto/branco
Quem bebe terá álcool no sangue. Este álcool entra nos pulmões e outros órgãos, incluindo o cérebro,
o que vai afectar os puderes do motorista. Fica com reacções mais lentes.
Em caso de acidentes, sempre um motorista com álcool tem culpa; automaticamente.
O tráfigo tem meios para medir o álcool no corpo do motorista, por exemplo: nos pulmões.
A substância no aparelho deve ficar com cor de laranja (contém dicromato de potássio).
O motorista deve soprar o aparelho.
Quando passa álcool, o dicromato reage com o álcool, formando iões Cr
3+ que têm uma outra cor: verde.
O tràfigo vai te prender e não pode continuar com o carro.
Um dos produtos é ácido acético.
Exercício 49
- Acha este controle útil e justo, científico e moral?
- Dá as semi-equações e a equação total.
- Explique as observações
Papel fotogáfico contém uma camadinha de cristais finos de brometo de prata.
Logo que raios de luz (=energia solar) entra em contacto com um tal cristal, isto afecta o cristal:
AgBr(s)

Ag(s) + Br
2(g)
Ag(s) assim é preto e Br2 escapa de forma gasosa.
No papel ainda não se vê nada deste processo, logo depois da chegada de luz. Mas o efeito já está lá.
Falta o banho de revelação: Cada parte afectada do papel, cada cristal afectado, já tém um pouco de prata metálica e
vai agora, no banho de revelação, reagir completamente com as substâncias no banho: hidróxido e dihidroxibenzeno.
2AgBr(s) + 2KOH(aq) + H
2O + OH
-  2Ag(preto) + outras substâncias
2Ag(preto) + outras substâncias
Quanto mais luz ataca os cristais, mais prata vai se formar e mais preto o resultado.
Atenção:
Ainda há muito Brometo de Prata que sobrou e isto com certeza não pode ficar aí.
Criaria grande problemas logo que mais luz tem contacto com o papel fotografia.
Portanto, o Brometo de Prata que sobrou deve sair por meio duma reacção com tiosulfato de amónio (também uma reacção redox). Esta solução é chamada: fixativo.
AgBr(s) + 2(NH4)2S2O3(aq)
 NH4Br(aq) + (NH4)3(AgS4O6)(aq)
NH4Br(aq) + (NH4)3(AgS4O6)(aq)
O papel agora já tem imagem. Afinal só fica secar o papel.
Exercício 50
Controle de todas as reacções de 7.2 os números de oxidação e suas mudanças.

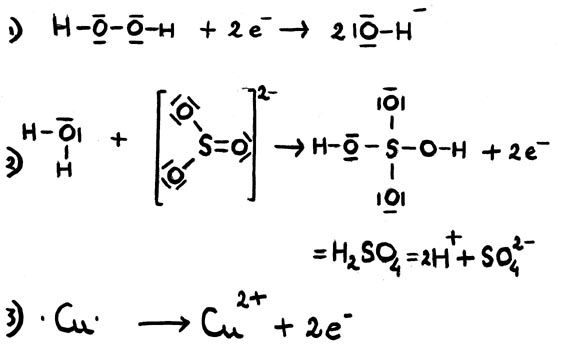
 2
2 3
3




 Quem bebe terá álcool no sangue. Este álcool entra nos pulmões e outros órgãos, incluindo o cérebro,
o que vai afectar os puderes do motorista. Fica com reacções mais lentes.
Quem bebe terá álcool no sangue. Este álcool entra nos pulmões e outros órgãos, incluindo o cérebro,
o que vai afectar os puderes do motorista. Fica com reacções mais lentes.