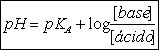Existem vários ácidos orgânicos e os mais importantes neste curso são os com grupo(s) carboxílicos (os ácidos alcanóicos).
- Tabém o fenol é um ácido (um pouco já tratamos neste módulo)
- Os aminoácidos são ácido e base;
- Os ácidos gordos.
Exercício 8
Considere a polaridade das ligações no grupo carboxílico.
O que pode ser a causa do carácter ácido deste grupo?
Exercício 9
O grupo carboxílico não é um ácido muito forte.
Comparando ácido metanóico com tricloro ácido metanóico, podemos notar de que o último é bastante mais forte.
Explique este fenómeno.
Fenol (benzeno com um grupo hidroxilo) é uma substância líquida com um carácter ácido fraco.
Álcoois (também com grupo hidroxilo) não têm este carácter ácido.
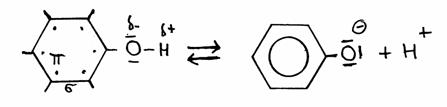
O facto de fenol doar H+ é causado pela presença do grupo benzeno (com electrões deslocados no anel); a ausência do H+ e a presença do O- cria ainda mais deslocação de electrões o que estabiliza ainda mais o anel.
Isto justifica a perca razoável fácil do H+.
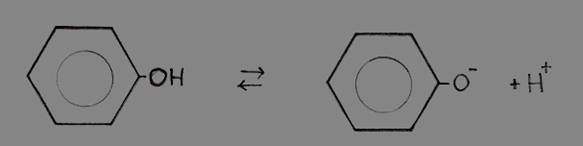
Fenol
O electrão extra do fenolato vai participar na deslocação geral dos 6 electrões do anel, assim estabilizando o fenolato.
Os oxiácidos formam-se - de modo geral - a partir do óxido que reage com água.
Exemplo: P2O5 + 3H2O
NOTA BEM: são reacções nas quais não muda o número de oxidação.
Exercício 10
Dá as equações das reacções de formação dos seguintes oxiácidos: ácido sulfúrico, ácido carbónico, ácido hiperclórico e ácido permangánico.
A maior parte destes óxidos vem dos não-metais (não todos!).
Hidrácidos formam-se directamente numa reacção dum elemento (muitas vezes um não-metal) com hidrogénio.
Exemplo é cloro com hidrogénio: Cl2(g) + H2(g)
Exemplo especial: HCN
Exercício 11
Examinando os não-metais, podemos chegar aos seguintes hidrácidos: HCl, HBr, HI, H2S, HF.
Existem mais ligações entre Hidrogénio e não-metais, tais como H2O e NH3.
Explique o carácter destas substâncias em termos de ácido / base.
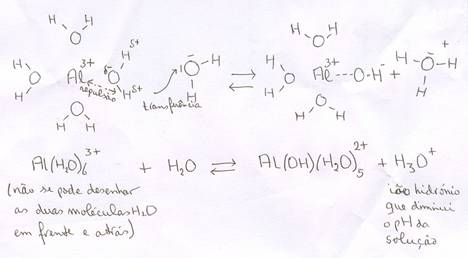
Certos iões com cargas positivos 2+ ou 3+ têm a propriedade de atrair fortemente as moléculas de água. Ou seja, ácidos catiónicos somente existem no meio aquoso.
Estes iões atraem os lados negativos (δ-) das moléculas de água, criando uma repulsão aos átomos de Hidrogénio (que têm uma carga δ+).
ácido catiónico (=ião positivo de um metal) com água
Assim cria-se a possibilidade de cedência de H+.
São alguns iões multipositivos, logicamente dos metais: Al3+, Cu2+, Fe2+ ou Fe3+, e outros.
Exercício 12
Qual é a lógica que diz: ácidos catiónicos - de modo geral - são soluções com iões multipositivos metálicos?
Resposta
Um caso especial dum ião positivo com carácter ácido é o ião amónio:
NH4+ + H2O
Exercício 13
Explique qual lado deste equilíbrio domina; porquê assim e qual a consequência na prática?
Iões negativos – normalmente – podem servir de base, i.é, querem captar protões.
Exercício 14
Explique por que é que não era de esperar que iões negativos podem servir de ácido.
Todavia, existem certos iões negativos que podem servir de ácido, i.é, podem ceder H+.
Por exemplo: HCO3-.
Este exemplo já mostra que se trata de partículas anfotéricas. Portanto, este tipo de iões negativos que contêm Hidrogénio, constam na tabela de ácidos e bases em ambas as colonas.
Favor de controlar isto.
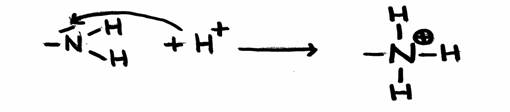





 ou
ou