|
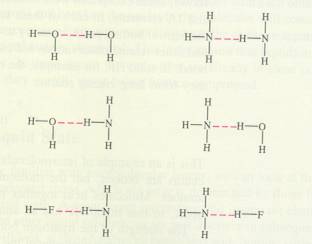
Sabemos que as substâncias são constituídas pelas partículas fundamentais: átomos ou iões e estas partículas, normalmente, não ficam sozinhas.
Quase sempre ficam ligadas umas às outras de qualquer maneira. Só os átomos dos gases nobres ficam 'solteiros'; não se ligam com um ou mais outros. Ligar partículas pode-se realisar de várias maneiras, mas sempre acontece na parte exterior da partícula. Portanto, sempre tem a ver com os electrões de valência nas últimas camadas dos átomos. Qualquer maneira de ligar partículas chamamos uma ligação química das quais tramos aqui as três mais importantes. O resultado duma tal ligação química tem consequências enormes para as propriedades da substância. |
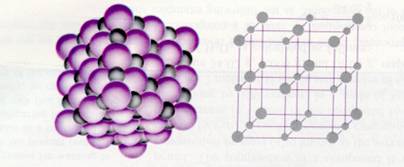
ligação iónica = atracção entre iões positivos e negativos |
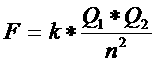


Ligações covalentes = electrões compartilhados entre dois átomos |


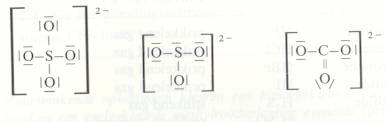
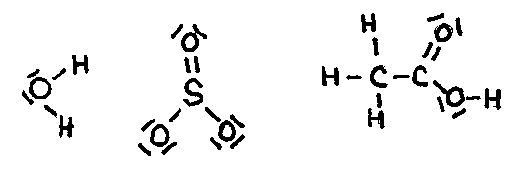
| mono | 1 | di | 2 | tri | 3 | tetra | 4 | penta | 5 |
| hexa | 6 | hepta | 7 | octa | 8 | nona | 9 | deca | 10 |
| N2O | NO | N2O3 | CuCl | PbS | SO2 |

| I | II | III | IV | V | VI | VII | VIII | |
| 1 | H | He | ||||||
| 2 | Li | Be | B | C | N | O | F | Ne |
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar |
| 4 | K | Ca | Ga | Ge | As | Se | Br | Kr |
| 5 | Rb | Rb | In | Sn | Sb | Te | I | Xe |
| 6 | Cs | Bi | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra |
| metais | Cs |
| metalóides | Po |
| não metais | Se |
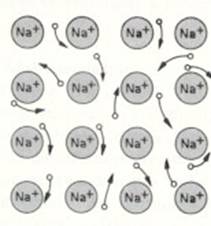
| Ligações metálicas | muitos metais têm valor baixo de E |
| Ligações iónicas | ΔE: > ±1,6 |
|
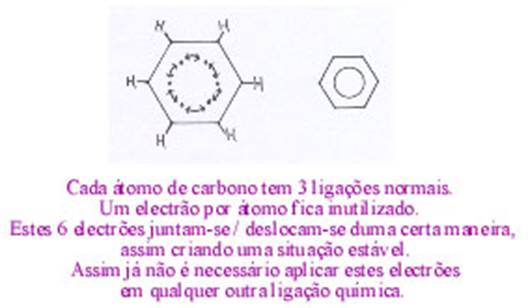
Ligações covalentes
-covalente não polar - covalente polar |
0 < ΔE < ±1,6
0 < ΔE: < ±0,4 ±0,4 < ΔE: < ±1,6 |

| CS2 (ΔE = ±0) | CO2 (ΔE = ±1.0) | H2O (ΔE = ±1.3) |
| Ligações covalentes apolares | Ligações covalentes polares | Ligações covalentes polares |
| Moléculas não polares | Moléculas não polares | Moléculas polares |
| Não há dípolo | Não há dípolo | Dípolo |
| Não existem δ+ e δ- | Existem δ+ e δ- cujos centros sobrepõem | Os centros de δ+ e δ- não sobrepõem (ficam separados) |
|
S=C=S
|
O = C = O
δ - δ+ δ- |
δ +
δ +
H H \ / O δ - |


| simples: | Na+ Cl- H+ |
| complexos: | H3O+ OH CO32- |
H-H |
- 4,36 | H-F |
- 5,63 | N≡N |
- 9,45 | C-F |
- 4,4 |
F-F |
- 1,53 | H-Cl |
- 4,32 | C≡C |
- 8,3 | C-Cl |
- 3,3 |
Cl-Cl |
- 2,43 | H-Br |
- 3,66 | C≡N |
- 8,9 | C-Br |
- 2,8 |
Br-Br |
- 1,93 | H-I |
- 2,99 | C=O |
- 8,0 | C-I |
- 2,4 |
I-I |
- 1,51 | H-O |
- 4,646 | C=S |
- 2,6 | C-O |
- 3,5 |
H-O (alkanol) |
- 4,5 | N-H |
- 3,9 | C=C |
- 6,1 | H-S |
- 3,44 |
C-C |
- 3,5 | C-H |
- 4,1 | O=O |
- 4,98 | P-H |
- 3,22 |