


pipetas

balão (veja: http://nl.wikipedia.org/wiki/Maatkolf)
bureta (veja: http://nl.wikipedia.org/wiki/buret)
cilindro graduado (veja cilindro graduado
seringua de gás
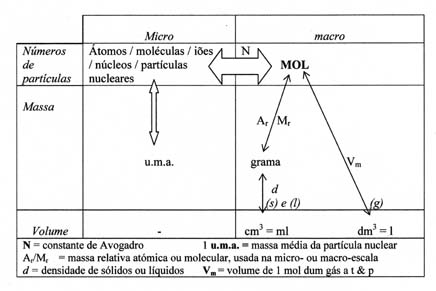
| A análise química podemos dividir em duas áreas: | |
| 1. a análise qualitativa: quais a(s) substância(s)? | |
| 2. a análise quantitativa: quanto? |
(veja também módulo 1)
Lembrar:
| Partícula | Massa (g) |
Massa (u.m.a) |
Carga |
| Electrão | 9,1*10-28 | ||
| Neutrão | 1,67495*10-24 | ||
| Protão | 1,67254*10-24 |
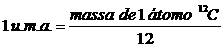
| o número de Avogadro = 6.1023 |
|
Um MOL é 6.1023 |
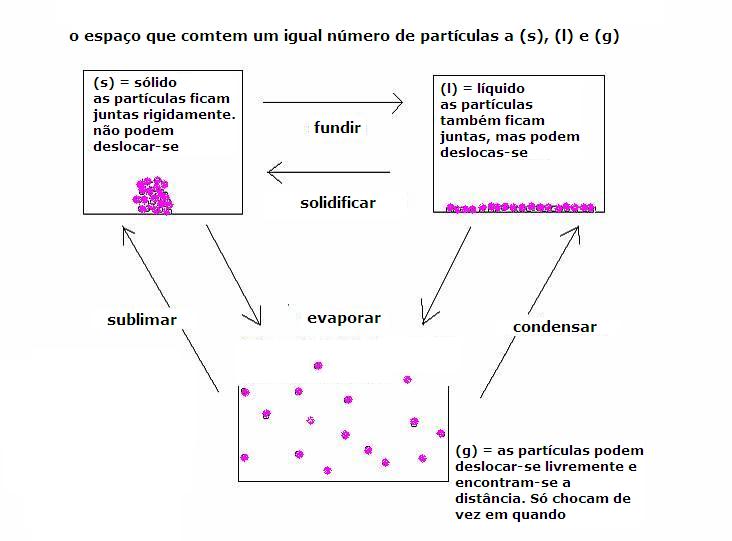
| CO2 | O2 | NH3 | |
| 0°C | 75·10-3 mol/l | 2·10-3 mol/l | 52 mol/l |
| 25°C | 34·10-3 mol/l | 1·10-3 mol/l | 26 mol/l | 100°C | 0,0·10-3 mol/l | 0,7·10-3 mol/l | 0,0 |






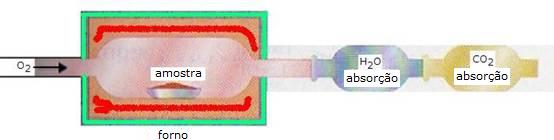
| M = 2DH |
 2H2O os coeficientes significam:
2H2O os coeficientes significam:
| método para responder uma tal pergunta: | |
| 1 | CH4(g) + 2 O2(g) |
| 2 |
sublinar as substância de tens dados ou de que existem perguntas. CH4(g) + 2 O2(g)
|
| 3 | Portanto, 1 mol CH4(g) reage com 1 mol CO2(g) (proporção é 1:1) |
| 4 | 16 gr CH4(g) produzem 44 gr CO2(g) (aqui aplicamos as massas moleculares) |
| 5 |
na realidade não temos 16 gramas, mas somente 4 gr para queimar.
O factor que vamos introduzir aqui é 4/16 4/16 x 16 gr CH4(g) produzem 4/16 x 44 gr CO2(g) afinal: condições padrão quer dizer: a temperatura de 25°C e pressão de 1 atm. Àquelas condições 1 mol gás = 22,4 litros 1/16 x 44 = 11 gr CO2(g) são produzidos, o que é igual a 4/16 mol = 4/16 x 22,4 litros CO2(g) = 5,6 litros |



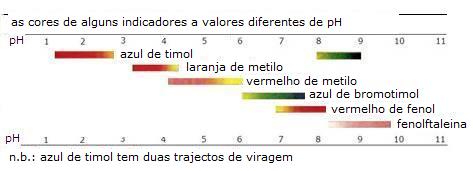
| A fim de observar este momento, de modo geral, precisamos um indicador | |
| No caso de uma titulação ácido base: | um indicador ácido base |
| No caso de uma titulação redox: | um indicador redox |
| um ácido fraco orgánico | um redutor fraco orgánico |
| HIn |
RedIn |
| HIn tem outra cor do que In- | RedIn tem outra cor do que OxIn |
| a cor de HIn ou In- | a cor de RedIn ou OxIn |
| somente podemos observar claramente quando o equilíbrio fica (suficientamente) a um lado, seja à esquerda seja à direita. | |
|
A cor que o indicador toma depende so ambiente:
Num ambiente ácido (ou reduzindo) os equilíbrios em cima mudaram para esquerda e assim domina a cor de HIn (ou de RedIn). Isto pode diferer bastante por indicador. |
|
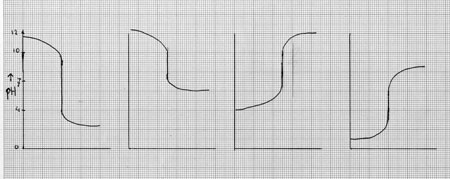
| titulação dum ácido forte com uma base forte: | pH = 7 |
| titulação dum ácido forte com uma base fraca: | pH < 7 |
| titulação dum ácido fraca com uma base forte: | pH > 7 |

|
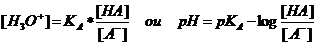
| Executar as seguintes três experiências segundo os seis pontos do exercício especial: |
Aponta cada vez, durante a experiência, tudo que faz, tudo que observa, tudo que pensa (em termos químicos). Depois, faça um relatório.
Cuida com que sempre ficas com substância desconhecida em estoque. De cada observação e cada vez, tira as suas conclusões; assim será possível evitar muita investigação superflua. |
| As três experiências são: | Os seis pontos de acção para cada experiência são: |
|
|
| Executa as quatro experiências em baixo segundo os quantro pontos do exercício especial: |
Anota cada vez, durante as experiências, tudo que faz, observa e pensamento (em termos químicos, claro) e ao fim, faça um relatório.
Cuidado: faça que a substância a investigar sempre fique em estoque. De cada observação tira as tuas conclusões; assim muita investigação fica superflua. |
| Os 4 pontos de acção em cada exercício são: | Os 4 exercícios são: |
|
respeita o dado no rótulo da garafa, a percentagem de álcool. |
| O objectivo é de executar as titulações que seguem em grupos, segundo os 10 pontos de acçãl deste exercício, na sequência certa!: |
Cada vez, durante a titulaçào, anota tudo que faz e que pensa (em termos químicos naturalmente) e ao fim, faça um relatório.
Faz com que todo u tempo ficas com um estoque da substância a investigar. De cada observação, tire conclusões. Assim muita investigação tornar-se-á supérflua. |
| Os 10 pontos de acção de cada investigação: | Os 6 exercícios são: |
|
|
| Segundo os pontos I - III e no teu grupo, vais preparar três soluções tampão e controlá-las. Para tal, pode escolher de seis substâncias que deves pesar ou tirar na quantidade certa. |
Aponte, durante a experiência, tudo que faz, observa en seus pensamentos (no sentido químico) e porteriormente faz um relatório.
Faça com que da substância a investigar sempre ficas com estoque suficiente. Tira de cada observação cada vez conclusões provisórias o que vai evitar muita pesquisa supérflua. |
| os três pontos de acção na pesquisa são: | as seis substâncias a usar são: |
|
|