| ELEMENTOS | PERCENTAGEM |
| Oxigénio | 47 |
| Silício | 28 |
| Alumínio | 8 |
| Ferro | 5 |
| Cálcio | 3,5 |
| Sódio | 3 |
| Potássio | 2,5 |
| Magnésio | 2 |
| Outros elementos | 1 |
ELEMENTO |
QUANTIDADE g/l |
| Cloreto | 19,2 |
| Iões sódio | 10,7 |
| Iões magnésio | 1,3 |
| Sulfureto, potássio, cálcio, brometo | ±1,8 |
| Outros elementos | ±1,4 |
| TOTAL: | ±35 gramas/litro |
| SUBSTÂNCIA | PERCENTAGEM |
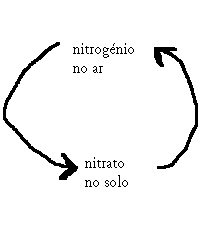
| Nitrogénio | 78 |
| Oxigénio | 21 |
| Árgon | 1 |
| Dióxido de carbono | 0,035 (aumentando!!) |
| Outros gases nobres | 0,003 |
