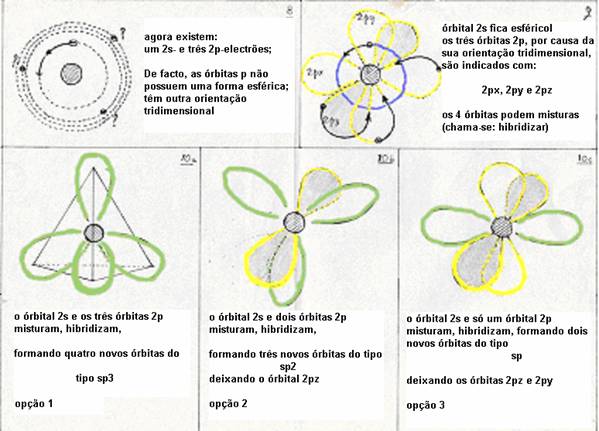
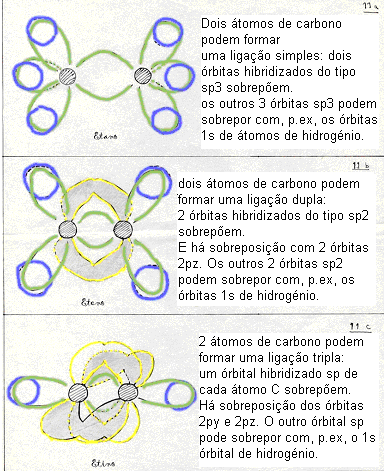
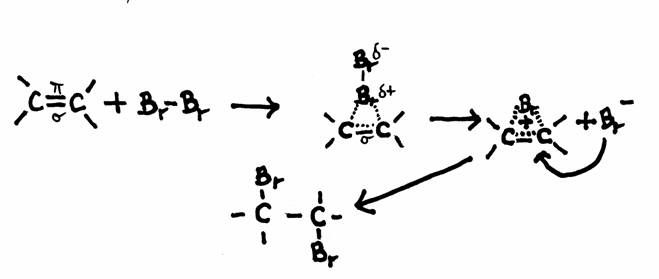
-
Iniciação
De qualquer maneira, provavelmente sob influência da luz, (mas pode ser com um catalisador) realiza-se um ataque à ligação dupla, que assim abre e se liga a um lado com o catalisador.
O outro lado fica aberto e pronto para atacar uma outra molécula do mesmo tipo. (veja também a iniciação da substituição simples): Cl - Cl 2Cl· (radical reactivo)
2Cl· (radical reactivo)
-
Na reacção principal ou prorrogação,
o radical de Cloro ataca a ligação dupla: Cl· + CH2 = CH - CH3 CH2Cl - CH· - CH3
este radical ataca as moléculas presentes em excesso, sendo as outras moléculas de propeno:
CH2Cl - CH· - CH3
este radical ataca as moléculas presentes em excesso, sendo as outras moléculas de propeno:
-
C3H6Cl· + C3H6
 C6H12·
C6H12·
-
C6H12· + C3H6
 C9H18·
C9H18·
-
etc.
É um processo corrente que produz cadeias enormes. Cada vez forma-se um radical maior, que cada vez pode captar mais um monómero.
Assim surgem as macromoléculas.
A prorrogação pode terminar quando o radical (o electrão impar) encontra um outro radical, também com um electrão impar.
Os dois electrões formam uma ligação normal (covalente) e a polimerização chega ao seu fim.
Há várias maneiras de terminar a poli-adição -
C3H6Cl· + C3H6
-
Terminação:
CnH2n· + Cl· CnH2nCl
CnH2nCl
ou:
CnH2n· + CnH2n· C2nH4n
C2nH4n
Os produtos da poli-adição, de modo geral, são os plásticos que existem em grande variedades, dependente da escolha dos monómeros.
Podemos limitar-nos a um só tipo de monómeros, mas também podemos escolher monómeros diferentes que participam no processo, formando os chamados copolímeros.
Um exemplo é o 'TEFLON' ou TEFAL = politetrafluoreteno, que a indústria aplica na fabricagem de panelas: uma camada de teflon na panela ajuda de evitar absorção de substâncias, i.é na prática: a comida não se pega tanto.
Exercício 14
Dá a estrutura do monómero de TEFLON (=ptfe)

Outro exemplo é PVC (em inglês: poly vinyl chloride) cloreto de polivinila = poli-cloro-eteno. É aplicado em grande quantidades nos tubos de canalização, mangeiras de água, isolamento eléctrico, etc.
No módulo de aplicações voltamos com mais exemplos.
Exercício 15
Apresenta a reacção da formação do PVC, a partir do seu monómero.
A técnica da polimerisação
Na fábrica fabricamos os polímeros de forma granular. Os gránulos sofrem outras manipulações em fábricas mais especializadas na formação dos produtos finais.De modo geral, os gránulos são aquecidos o que causa uma substância com mais plasticidade que apoia a moldagem. Podemos realizar dois processos diferentes neste processo:
- as moléculas não formam interligações; não surge uma rede tridimensional; o produto fica com uma certa flexibilidade. O material podemos reciclar: acercer e moldar de novo.
- as moléculas formam interligações (por exemplo porque sobraram ligações duplas); os produtos terão um caráctor muito duro, sem qualquer flexibilidade. Reciclagem é difícil.
Alcadienos ou alcatrienos também podem sofrer polimerisação com o resultado duma substância com macromoléculas aindo insaturadas. O produto da polimerisação ainda contem ligações duplas.
Isto cria um polímero especial: um polímero que ainda tem o carácter de borracha. A elasticidade destas substâncias podemos diminuir por (parcial) adição.
Conhecemos a aplicação nas fábricas de pneus: volcanisação.
E também tinta a óleo tradicional que ainda contem muitas ligações duplas que desaparecem na reacção com Oxigénio do ar, com o resultado duma camada dura.
Outro aspecto especial na formação destes polímeros é de misturar monómeros diferentes, assim criando copolímeros. As moléculas diferentes ligam-se alternadamente.
Exercício 16
Mostra a estrutura do copolímero formado dos monómeros eteno e propeno
As macromoléculas dos polímeros têm um tamanho tão grande que a própria substância sempre será um sólido. Quando dissolvem mais ou menos em água, por exemplo proteínas ou polisacarídeos, a mistura não fica transparente ou clara, mas sim mostra uma turvação: as moléculas assim dissilovidas podem ser observadas pelo olho nu.
Hoje em dia o mundo tem uma "química de polímeros", que sabe produzir substâncias com propriedades bastante especiais; são substâncias com aplicações específicas.
Os dois tipos mais importantes de polimerização são poliadição e policondensação. A policondensação tratamos depois.
Benzeno não exactamente contém ligações duplas; os 6 átomos C são ligados doutra maneira (veja módulo 4).
Adição do benzeno é possível, mas não é fácil. A molécula de benzeno, graças às 6 ligações especiais, tem um grande estabilidade.
Adição destroi esta estabilidade e, assim, fica difícil.
3. Substituição
Na substituição, um átomo H ou um outro grupo de átomos duma cadeia C é substituído por outro átomo ou grupo de átomos.Aquele novo é chamado 'substituente'.
Substituição numa cadeia alifática: exige calor e luz.
Substituição numa cadeia aromática: exige um catalisador.
Os alcanos (alifáticos) podem sofrer o processo de substituição: um processo lento no qual um átomo de Hidrogénio da cadeia de Carbono é substituído por um outro átomo, muitas das vezes um halogéneo.
A substituição por Cloro (Cl 2), por exemplo, decorre lentamente e só com ajuda de energia solar:
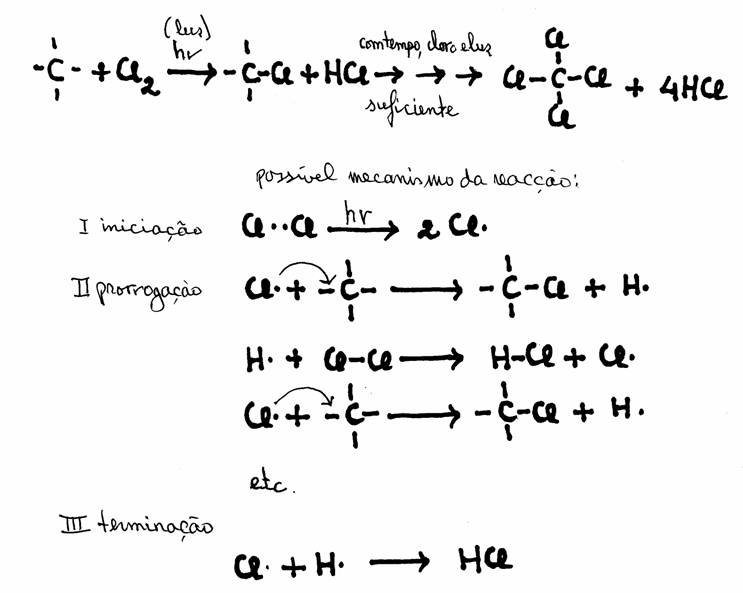
Exercício 17
- Explique a palavra 'terminação'; porque é que usamos aqui esta palavra?
- O que quer dizer aqui "etc."?
- Um radical com um electrão impar é muito reactivo. Porquê?
Exercício 18
Quem se disponibiliza-se de modelos, tente imitar a substituição do etano com cloro.
O grupo Nitrilo
Um grupo - C≡N chamamos "nitrilo", quando o C faz parte da cadeia principal. No caso de ter um grupo - C≡N de forma ramificação, portanto, não dentro da cadeia principal, falamos de 'grupo cianeto'.Na química inorgânica encontramos o ião cianeto: CN -
Formam-se grupos nitrilo pela substituição de cianeto por haleto-alcano:
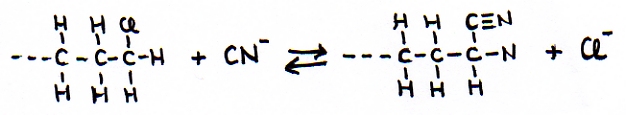
Exercício 19
Explique como é que podemos considerar esta substituição como método de prolongar uma cadeia-C.
Note bem que o grupo nitrilo contém uma ligação tripla.
A consequência é a possibilidade de adição, até três vezes, o que é muito especial:
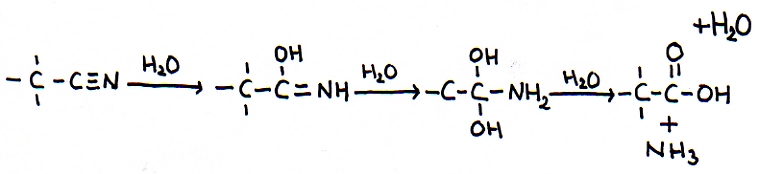
N.B.: Regra particular: mais do que um grupo OH ligado directamente com a cadeia-C não fica estável, perde água:
Adicionámos 3 moléculas de água e ao fim uma molécula de água foi devolvida. Ao fim são formados: um ácido alcanóico + amoníaco, dois produtos.
Substituição com H3PO3
Existe um método para substituir um grupo hidroxilo (OH) duma cadeia-C por um halogénio (F, Cl, Br ou I) através duma reacção com 'tri-haleto de fósforo'.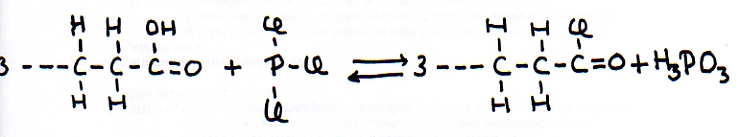
Substituição dos átomos H d0 benzeno é fácil. A estrutura estável não se perde; os 6 átomos C ficam ligados sem mudança.
Substuição acontece com grupos nitro, amino, alquil, sulfono e mais.
Exercício 20
Escreva, em estruturas químicas, a reacção de substituição de cloro ao tolueno.
Anote também as condições da reacção.
Consulte os livros de química para tal.
Resposta
4. Condensação & Hidrólise
4.1 Condensação
Duas moléculas ligam-se sob formação de água;ou
Duas moléculas ligam-se, formando uma molécula nova e uma molécula de água.
molécula 1 + molécula 2
por exemplo, a formação dum éster:
etanol + ácido etanóico
em fórmulas estruturais:
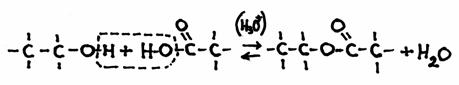
É um processo reversível, i.é, a reacção directa é a própria condensação e a reacção inversa é o oposto, chamada "hidrólise".
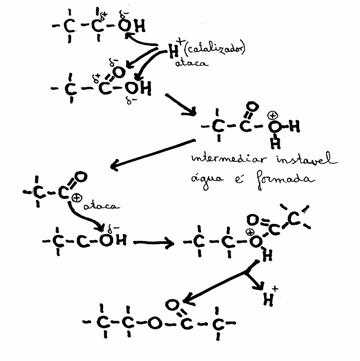
A formação dum éster, a partir dum álcool + um ácido carboxílico, pode ser acelerada com um catalisador. Para tal aplicamos um meio ácido, por exemplo, no qual os iões hidrónio (H 3O +) atacam um lugar negativo nos reagentes.
Um mecanismo que começa assim é chamado "electrófilo".
Existem outros mecanismos, onde se realizam ataques duma partícula negativo às partes positivas de qualquer molécula, chamados "nucleófilos".
Acontece que um álcool reage com um ácido não-orgânico, com o exemplo de glicerol com ácido nítrico.
Na bioquímica, o glicerol liga se às moléculas de ácidos gordos, formando assim os lípidos, mas a reacção com o ácido nítrico é bastante semelhante:
Exercício 21
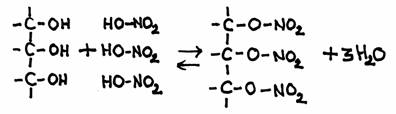
O produto tem o nome oficial "trinitrato de glicerol". No quotidiano conhecemos esta substância sob o nome de "nitroglicerina".
- Dá a equação da reacção em fórmulas moleculares.
- Explique o facto de que este nome"nitroglicerina" não é certo, segundo as regras IUPAC.
Resposta
Outro exemplo de condensação (e do inverso hidrólise) é a formação de éter e água dos reagentes álcool + (outro) álcool, por exemplo: etanol + propanol
4.2 Policondensação
Muitas moléculas ligam-se, formando tantas moléculas de água (ou - às vezes - uma outra pequena molécula).Forma-se uma macromolécula por meio do mecanismo de condensação e não forma-se somente uma molécula de água por reacção, mas muitas.
Por exemplo, glicol C 2H 4(OH) 2, tendo dois grupos OH, pode realisar o processo de condensação aos dois lados:
HO - CH 2 - CH 2 - OH
Cada grupo OH pode reagir com um grupo OH de qualquer outra molécula, cada vez formando água, ou seja, a molécula de glicol pode se estender para dois lados:
O produto, neste caso, é um poliéter, um sólido, enquanto que o reagente glicol é um líquido.
Exercício 22
- Anime esta policondensação com modelos
- Explique por que é que o poliéter será um sólido.
Produtos famosos de policondensação:
- Poli-éteres
- Poli-ésteres
- Poli-peptídeos
- Poli-saccarídeos
Na indústria já foram inventados muitos produtos deste tipo, e aplicados na prática.
Por exemplo, o material dos 'videotapes' é um produto de co-policondensação de glicol (1.2-dihidroxi etano) e ácido tereftálico (1.4-benzeno diácido carbóxílico).
Exercício 23
Mostra uma parte da estrutura deste polímero.
Exercício 24
Existe uma co-policondensação dos monómeros glicol e ácido oxálico, com um pouco de ácido sulfúrico concentrado que serve de catalisador.
A reacção inicia com um ataque de protões ao ácido oxálico, formando um ião carbóneo, um C com carga positivo (isto é o passo mais lente).
- Tente indicar o mecanismo da reacção, sabendo que os dois monómeros ligam alternadamente.
- Explique o facto que o passo mais lento define a velocidade total da reacção.
Hidrólise:
Já notámos que o processo 'hidrólise' é o contrário de condensação: uma molécula, usando água, divide-se em mais novas moléculas.Exercício 25
Mostre o que se forma no hidrólise total de etilo-acetato.
4.3 Saponificação
A saponificação é um processo que aplica a hidrólise em meio básico, a partir duma substância gorda.Muitas vezes utilizamos gordura animal para tal. A gordura sofre hidrólise formando os produtos (glicerol e o ácido gordo; pode ser ácido palmítico) dos quais o ácido gordo de repente muda em sabão,
enquanto o H + do ácido é substituído por Na + ou K + (aplicando a base KOH ou NaOH).
Os ácidos gordos tratamos no módulo 12, Bioquímica, e - relacionado com isso - a sua saponificação mais em pormenor.
Também haverá um módulo 'Aplicações da Química' onde tratamos a técnica especial da saponificação.
5.Reacções REDOX na Química Orgânica
5.1 Introdução
Acontecem muitas reacções redox na química do carbono; também as substâncias orgânicas têm o puder para ceder ou captar electrões.N.B.
falando aqui de oxidação, de modo geral isto não indica combustão com oxigénio, mas sim outras mudanças do número de oxidação. Novas substâncias formam-se.
[Combustão com oxigénio resulta em dióxido de carbono e água].
Na tabela REDOX encontramos poucas substâncias orgânicas, portanto, para elaborar as semi-equações, e para conhecer o número de electrões transferidos, temos que pensar bem de acordo com certos métodos. Não surgem automaticamente na tabela.
Combustão completa
Qualquer substância orgânica, com C e H (e outros elementos) reage fortamente com Oxigénio. O mais reactivo, o elemento mais pronto para reagir é o H, formando logo água, H 2O.Depois (i.é, quase simultaneamente) reage o C formando CO 2.
A presença de S ou N ou P ou outros elementos ainda, pode criar mais produtos, como SO 2 e os óxidos de nitrogénio N xO y. Estes produtos (gasosos) são responsáveis para a poluição do ar.
Assim, o melhor gasolina é aquele que não contém enxofre ou nitrogénio.
Combustão incompleta
No caso de haver Oxigénio insuficiente, H ainda há de formar água, mas já não haverá Oxigénio suficiente para queimar todo o Carbono completamente.Assim podem formar-se: CO (monóxido de carbono) ou mesmo o carbono pode ficar sem ligação e fica C (fuligem).
Queimar uma substância num espaço sem ventilação pode assim criar CO o que é um gás muito venenoso.
Reacções redox típicas na química orgânica
A descrição das reacções redox encontra-se no módulo 10 onde surgiu a definição da mudança do número de oxidação.Reacções redox acontecem muito na química do carbono e nem sempre é fácil descrever exactamente a transferência dos electrões.
Também não disponibilizamos de tabelas redox que mostram todas as semi-reacções.
Portanto, neste ramo da química, é melhor investigar as mudanças do N ox. Uma das mudanças sempre é um dos átomos de carbono, quer oxidante quer redutor.
Exemplo
Consideramos metanol:
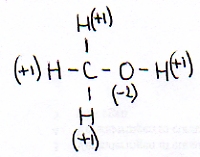
De modo geral podemos afirmar que:
- o Nox de H nas substâncias é e fica +1
- o Nox de O nas substâncias é e fica -2
- na substância metanol existem três ligações C - H, uma ligação O - H e uma ligação C - O .
- o Carbono deve ter o Nox = -2 [controlar por favor]
Exercício 26
Calcular o número de oxidação dos átomos de carbono nas seguintes substâncias:
| Etano | etanol | etanal | etoxietano | etiletanoato | metano |
Oxidar uma cadeia apolar é bastante difícil. Uma distribuição bem equilibrada dos electrões de valência cria apenas diferenças pequenas nas electronegatividades.
A presença de cargas δ + e δ - causa ataques electrófilos ou nucleófilos.
Assim, a cadeia de carbono que já contém um átomo de oxigénio pode sofrer oxidação, mais ou menos facilmente. O átomo de oxigénio, ou outros átomos com grande electronegatividade, causa uma boa polaridade na própria substância.
Temos que considerar o facto que ataques exigem uma polaridade, mas também um lugar onde mais oxigénio pode ligar.
Portanto, regra geral ou condição prática para este tipo de oxidação de um átomo C é a presença duma ligação do próprio carbono com um átomo de hidrogénio + uma ligação C - O do mesmo carbono.
O oxidante O toma posição entre o C e o H.
5.2 Oxidar os vários grupos orgânicos
Alcanos

 Oxidar alcanos não é tão fácil. Todas as ligações dos alcanos são apolares com pouca afecção para oxidantes.
Oxidar alcanos não é tão fácil. Todas as ligações dos alcanos são apolares com pouca afecção para oxidantes.
Oxidar alcanos acontece em particular com oxigénio da atmosfera: combustão directa ou indirecta, por exemplo a combustão de gás natural com os produtos água e óxidos de carbono.
Exercício 27
Cumbustão completa de gás natural vem com mudanças de números de oxidação.
Mostre estas mudanças.
Álcoois

Combustão directa dum álcool também é possível, mas aqui existe a outra maneira com oxidantes mais fracas e com produtos especiais.
Por exemplo, o ião dicromato no meio ácido pode oxidar o alcanol primário formando o produto 'ácido' via o intermediar alcanal.
Exercício 28
As seguintes substâncias podem ser oxidadas com dicromato, sim ou não?
Caso sim, qual é o produto?
Explique a sua resposta.
- 2-propanol
- Etadiol (glicol)
Exercício 29
Afirmação: 2-metil 2-propanol pode ser oxidado com iões de permanganato.
A afirmação é sim ou não verdadeira?
Explique a sua resposta.
Exercício 30
- Dá as fórmulas electrónicas das duas substâncias orgânicas e compare o número presente dos electrões de valência.
- Também dá as duas semi-reacções em fórmulas moleculares.
N.B.
Na oxidação dum álcool (alcanol), a primeira passe é a formação dum átomo C com dois grupos OH (controle!).
Já sabes que uma tal situação não fica estável; dos dois grupos OH afasta-se uma molécula de água, deixando o C com uma dupla ligação com O (alcanal, alcanono, ácido carboxílico).
Alcanais


Para oxidar alcanois usamos muitas vezes permanganto ou dicromato acidulado; i.é, com um oxidante bastante forte.
Para oxidar alcanais, tais oxidantes fortes não são necessários.
O alcanal contem um grupo aldeido (-CHO). A ligação C=O é bastante polar e oxidantes conseguem facilmente atacar a parte δ + do carbono (em busca de electrões).
Oxidantes fracos, como iões de prata ou cobre(II) já podem oxidar os alcanais, o produto sendo um ácido (grupo carboxílico).
Portanto, é mais fácil oxidar um alcanal do que um alcanol.
Exercício 31
- Qual será o produto da oxidação de etanal?
- Idem para metanal (n.b.: aqui temos uma situação extraordinária!!)
Alcanonos

No caso de alcanonos, existe uma boa electronegatividade entre C e O, mas falta uma ligação C - H para receber mais O.
Será mais difícil oxidar alcananonos sem quebrar ligações C — C .
Exercício 32
Afirmações:
- O alcanono contem um grupo polar
- O alcanono não pode ser oxidado facilmente
ácidos alcanóicos
Exercício 33
Afirmações:
- O ácido metanóico pode ser oxidado facilmente
- O ácido etanóico pode ser oxidado facilmente
Resposta
Exercício 34
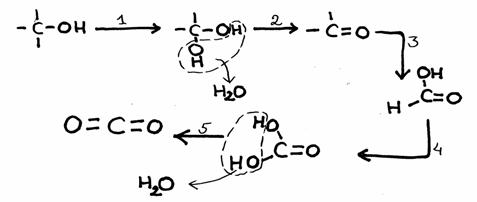
Estude bem o esquema de reacções em baixo, com 5 passos.
De cada passo, indique se seja sim ou não uma reacção redox.
Caso sim, dá um possível oxidante.
Para lembrar:
- nestes casos, uma oxidação vem com a introdução dum átomo O dentro de C e H.
- nas substâncias orgânicas, de modo geral é instável a presença de dois grupos OH ao mesmo C.
- os produtos finais aqui são dióxido de carbono e água.

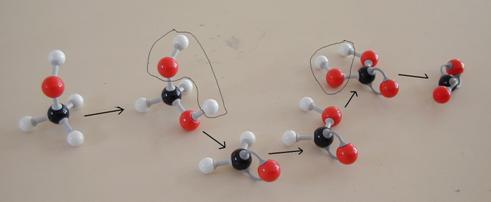
As mesmas reacções em modelos:

Exercício 35
Carbeto de cálcio (C 2H 2) é uma substância branca e sólida com cheiro específico, muito instável, reage espontaneamente com água.
Os produtos desta reacção: um gás com cheiro picante e uma solução básica. Quando o gás passa uma solução aquosa de Bromo, a cor amarela desaparece.
Explique o que acontece durante a formação do gás, usando fórmulas estruturais. Será que isto é uma reacção redox?
Resposta
éteres
É verdade que aqui encontramos um O ligado a átomos de carbono, só que neste caso isto não resulta em grande polaridade.Podemos ver uma certa simetria na molécula, que por isto fica com pouca polaridade. Será difícil oxidar éteres.
Exercício 36
Explique a eventual possibilidade de oxidação com dicromato acidulado de:
- Butano
- 2-metil propanol-2
- acetono
- metoximetano
ácidos carboxílicos
É difícil oxidar ácidos orgânicos. Não falta polaridade, mas sim falta mais um lugar ao C δ+ onde mais Oxigénio queria ligar.A mesma podemos afirmar acerca dos ésteres.
Uma ligação entre dois átomos de carbono (C - C) podemos oxidar muito dificilmente. A ligação é forte demais.
Só numa combustão completa ou com oxidantes extremamente fortes (como ácido sulfúrico concentrado e quente) isto será possível.
Exercício 37
Ácido metanóico e di-ácido carbónico podem ser oxidados facilmente.
Explique porque é que estes ácidos 'ácido fórmico' e 'ácido oxálico' são exepções na regra geral.
No caso de ácido oxálico, mostre as fórmulas electrónicas do reagente e do produto e explique as diferenças.
5.3 Os oxidantes Cu2+ e Ag+
São oxidantes não muito fortes, até um pouco fracos.Constam na tabela REDOX, mas note bem, o Cu 2+ aqui não tem cobre metálica como produto (Cu), mas sim o ião Cu +.
O produto do oxidante Ag + é o metal Ag. Portanto, ambos os oxidantes captam um electrão por ião.
Reagente de FEHLING
Aqui o oxidante é o ião Cu 2+ formando o ião Cu +. É isso a base da própria reacção.Mas as condições são um pouco mais complicadas:
- Apenas reage em meio básico
- Apenas reage com aquecimento
Para criar o meio básico adicionamos NaOH(aq). Mas logo ao adicionar surge um problema:
Os iões Cu 2+ reagem com OH - formando um precipitado Cu(OH) 2.
Para evitar este precipitação precisamos duma outra substância: Na-K-tartrato(aq).
A mistura de NaOH(aq) e Na-K-tartrato(aq) chamamos Fehlings B
Agora vamos misturar Fehlings A e Fehlings B.
Logo depois de misturar, o precipitado Cu(OH) 2 vai desaparecendo e surge uma solução clara de cor azul escuro.
A mistura de Fehlings A e B é chamado: o reagente Fehlings.
O reagente Fehlings é uma mistura instável; só fica bem durante curto tempo. Nos laboratórios guardamos os reagentes A e B separados.
O reagente Fehlings sempre preparamos uns minutos antes da sua aplicação.
Parte principal do reagente é o ião Cu 2+, o oxidante que pode oxidar um redutor.
O redutor a investigar com Reagente Fehlings pode ser fraco, p.ex. etanal que também se encontra num tubo de ensaio.
O aquecimento realiza-se logo depois de juntar o reagente Fehlings (uns mls) à solução a investigar (que contém um redutor orgânico).
Aquecendo - observamos a formação dum precipitado: no início de cor verde (o primeiro precipitado é CuOH) para logo depois formar o precipitado final, Cu 2O de cor vermelha.
Foto's
Reagente Tollens; Solução de Prata em Amoníaco
No caso de aplicar o oxidante Ag +, o procedimento é muito semelhante comparado com o reagente de Fehling:- Só reage em meio básico
- Só reage com aquecimento
Aqui é muito importante trabalhar com tubos de ensaio bem limpos, porque ao fim queremos ver uma camada de prata na parede do tubo.
No primeiro tubo temos uma solução de nitrato de prata (AgNO 3(aq)). A esta solução juntamos - pouco a pouco - amónio.
N.B: amoníaco em si já é básico, não é necessário juntar NaOH!
Inicialmente forma-se um precipitado de AgOH(s) de cor castanha, mas continuando juntar amónio, o precipitado desaparece e a solução torna-se transparente e incolor. Assim esta solução está pronta para aplicar de oxidante.
Juntando esta solução a, por exemplo, uma solução dum redutor fraco (pode ser etanal ou um açúcar com grupo aldeido) num tubo bem limpo, e aquecendo a mistura num banho maria, forma-se uma camada de prata na parede do tubo: observamos um tipo espelho de prata bonito.
Foto's
A função do Tartrato e do Amónio:
Para compreender como é que estas substâncias ficam os iões de Cu 2+ ou Ag + solúvel numa solução básica, observa bem as estruturas em baixo. De facto, os iões ficam separados dos iões hidróxido, sendo empacotados, embalados dentro das moléculas polares de Tartrato ou Amoníaco. Ficamos na solução básica com iões muito complexos, mas sem precipitados.Exercício 38
O estudante deve ser capaz de explicar, em próprias palavras, acerca destes reagentes, o seguinte:
- Os equilíbrios e sua estensão das semi-reacções
- A influência do meio básico
- A influência da temperatura
- Como evitar a formação de precipitados
-
As observações a fazer durante as reacções
A aplicação destes reagentes tramos também no Módulo 12: Bioquímica.
6. Reacções ácido/base
Introdução
Muita informação sobre reacções ácido/base encontramos no módulo 9, mas aqui falamos em particular das reacções ácido-base da química orgânica.
Observações gerais:
- De modo geral, os ácidos e bases orgânicos são fracos e muitos deles não só participam nas reacções ácido-base.
-
Podem também reagir em outros tipos de reacções.
p.ex.: O grupo carboxílico e o grupo amino, participam em reacções do tipo condensação na formação de ésteres ou peptidas. - Outra observação geral: átomos H ligados aos carbonos nunca são cedidos de forma H+ directamente.
- Podemos na química do carbono aplicar a regra já conhecida: um ácido sempre forma uma base conjugada e uma base sempre forma o seu ácido conjugado. Podemos aplicar as semi-reacções.
O grupo carboxílico e o grupo amino
Porque é que o grupo carboxílico comporta-se de ácido?
A razão é o facto de existir no grupo uma polaridade forte. Isto cria uma repulsão entre o átomo C e o átomo H, os quais ambos ficam com uma carga positiva.
(A repulsão causa de vez em quando a saída do H, de forma H+).
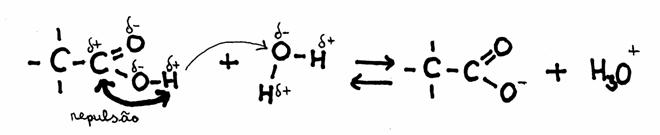
ácido + base base conjugado + ácido conjugado
base conjugado + ácido conjugado
Um grupo NH2, ligado a uma cadeia de carbono, é constituído de tal maneira que o átomo N (mais ou menos δ-) ainda contém um par de electrões livre que pode se disponibilizar para captar partículas sem electões, por exemplo, o ião H+.
Depois de captar um tal ião, o grupo torna-se positivo: - NH3+.
Exercício 39
Dá a reacção dum grupo amino, em estruturas, da captação de H+ vindo do ácido acético.
Exercício 40
Ácido oxálico (dois grupos carboxílico juntados = H2C2O4) não só é um ácido mais forte, mas também pode facilmente quebrar em duas partes ( 2 moléculas CO2).
Explique.
2 moléculas CO2).
Explique.
Fenol
Existe um tipo de grupo OH que funciona de ácido fraco, doutra maneira do que no grupo hidroxílico alifático: no caso de estar ligado ao anel de benzeno, o grupo OH aromático, sendo o mais conhecido o fenol: C6H5OH + OH- C6H5O- + H2O
C6H5O- + H2O
ácido + base base conjugado + ácido conjugado
base conjugado + ácido conjugado
Em estruturas, o fenol perde assim:
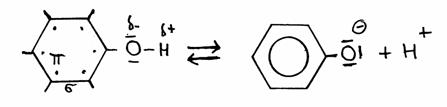
fenolato
Um facto especial é de que no fenolato, todos os electrões de valência do oxigénio, junto com os electrões do tipo π do anel, entram num estado de ressonância (veja o livro de referência), assim estabilizando este ião negativo. Isto tem a consequência de que o fenol fica com uma tendência de ceder H+, muito mais forte do que os álcoois alifáticos.
Exercício 41
Explique porque é que a força das substâncias tem a ver com a eventual reversibilidade.
O grupo hidroxílico alifático
Já sabemos que o grupo OH (alifático) pode somente perder o H+ (reagir como ácido) quando o C também está ligado a um O (i.é, num grupo carboxílico).
O grupo hidroxílico alifático puro, i.é um grupo álcool, normalmente não pode servir de ácido nem de base, ou seja, não pode ceder nem captar iões H+.
Somente no caso de aplicar uma substância muito agressiva, reactiva, como o metal Sódio, podemos realizar uma substituição de H por Na:
CH3 - CH2 - OH + Na· CH3 - CH2 - O- + Na+ + H·
Logo que existem 2 radicais H· forma-se uma molécula H2(g).
CH3 - CH2 - O- + Na+ + H·
Logo que existem 2 radicais H· forma-se uma molécula H2(g).
O outro produto chamamos 'etanolato de sódio, uma substância com carácter bastante básico.
Em estruturas:
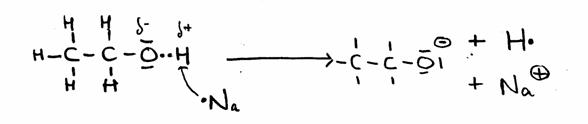
Exercício 42- Note bem o que acontece com os electrões de valência.
-
Explique porque é que CH3 - CH2 - O- (+ Na+ ) tem um carácter básico muito forte.
(enquanto que o álcool quase não tem um carácter ácido).
A reacção não é considerada um equilíbrio. - Será que esta reacção é tipo ácido/base ou redox?
Amfolitos
Existem moléculas orgânicas onde a cadeia de carbono contém tanto um grupo carboxílico (ácido) como também um grupo amino (base). Aqui falamos de AMINO-ÁCIDO.
Estes moléculas têm as duas possibilidades: ceder e captar. Consequentemente, pertencem ao grupo de substâncias amfotéricas.
Vamos tratar estas moléculas no módulo 12, Bioquímica.
Exercício 43
Um aminoácido muito simples é alaninia (2-amino-ácido propanóico).- Dá a estrutura e explique onde e como se realizam as reacções amfolíticas.
- Explique o que é um ião duplo.