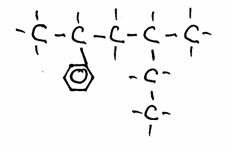
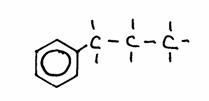


1 = elemento |
2 = símbolo |
3 = número atômico |
4 = massa atômico |
5 = electro- negati- vidade |
6 = Ponto de Fusão |
7 = Ponto de Ebulição |
8 = Raio atômico (x10-12m) |
9 = Raio iônico (x10-12m) |
10 = Raio vanderWaals (x10-12m) |
| Flúor | F | 9 | 19,0 | 4,0 | 54 | 85K= -152oC | 64 | 133 | 135 |
| Clóro | Cl | 17 | 35,5 | 3,2 | 172 | 239K= -152oC | 99 | 181 | 180 |
| Brómio | Br | 35 | 79,9 | 3,0 | 266 | 332K= -34oC | 114 | 196 | 195 |
| Iodo | I | 53 | 126,9 | 2,7 | 387 | 458K= 59oC | 133 | 219 | 215 |
| Astácio | At | 85 | 2,2 | 575 | 610K= 185oC | 140 |
| 1) |
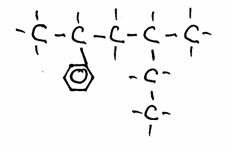
|
2) |
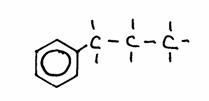
|
3) |

|
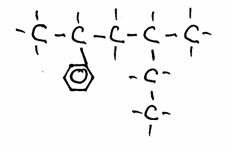 |
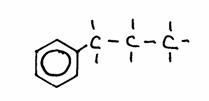 |
 |
| 2-fenilo, 4-metilo-hexano |
1-fenilo-propano;
ou
propilo-benzeno |
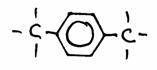
1,4-dimetilo-benzeno
ou
para-dimetil-benzeno (= p-dimetilbenzeno) |
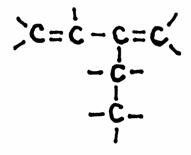
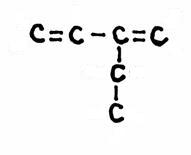
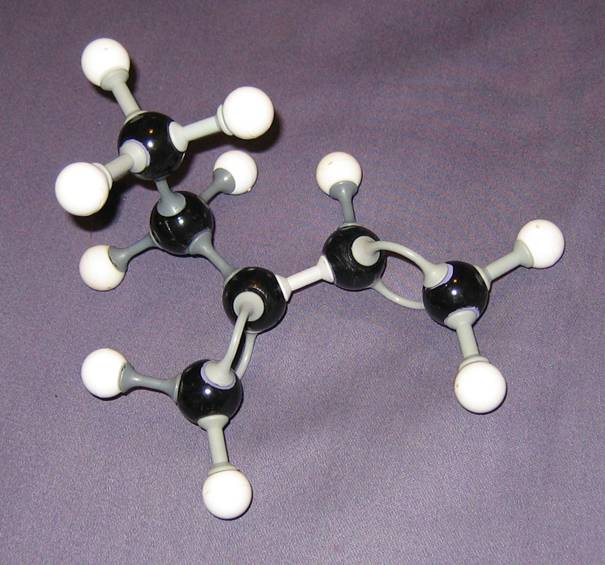


| 1 |
CH4(g) + 2 O2(g)
|
| 2 |
Sublinhar aquelas substâncias sobre as quais há dados ou há perguntas.
CH4(g) + 2 O2(g)
Não há dados nem perguntas sobre quantidades de Óxigénio ou água |
| 3 | Portanto, 1 mol CH4(g) produz 1 mol CO2(g) (proporção molar é 1:1) |
| 4 | 16 gramas CH4(g) produzem 44 gramas de CO2(g) (aplicando as massas moleculares) |
| 5 |
na realidade, não entram 16 g, mas somente 4 gramas na combustão.
O factor a introduzir é 4/16. 4/16 x 16 gramas CH4(g) produzem 4/16 x 44 gramas de CO2(g) afinal: (PTN quer dizer: a pressão e temperatura normal: 1 atm. e 0oC. Sob condição PTN, 1 mol de gás = 22,4 litros) 1/16 x 44 = 11 gramas de CO2(g) que são produzidos, i.é igual a 4/16 mol = 4/16 x 22,4 litros CO2(g) = 5,6 l |
| 1 | a equação certa: 2Fe(s) + 3Cl2(g) |
| 2 |
Sobre Fe e Cl2 há dados e sobre FeCl3 não há uma pergunta, portanto, só os dois reagentes participam no cálculo:
2Fe(s) + 3Cl2(g) |
| 3 | A proporção molar dos reagentes é: 2 : 3 ou melhor dizer: dois moles de ferro reagem com três moles de cloro |
| 4 |
O cloro está dado em moles (não é necessário mudar a unidade)
O Ferro vem em gramas, portanto duas moles de Ferro =2 x 55,8 (veja livro de tabelas, tabela V) 111,6 gramas de Ferro reagem com 3 moles de cloro. |
| 5 |
segundo os dados, temos no início 3 moles de cloro e 150 gramas de Ferro.
Ponto 4 mostra que 3 moles de cloro precisam apenas 111,6 gramas de Ferro, portanto:
há Ferro em excesso e o Cloro automaticamente será o reagente limitante. |
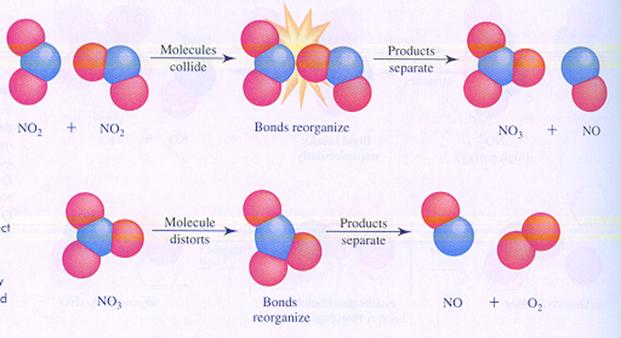
CH4 |
H2S |
NH3 |
H2O |
HCOOH |
HCl |
HCN |
|
H
| H - C - H | H |
H
/ S \ H |
H H
\ / N | H |
H
\ O | H |
OH
/ H - C = 0 |
H - Cl | H - C ≡ N |
| indicador | cor ácida | cor básica |
| tornesol | vermelho até pH 5,5 | azul desde pH 8,0 |
| azul de bromotimol | vermelho até pH 1,2 |
amarelo desde pH 2,8 tot 6,0 en blauw vanaf 7,6 |
| Fenolftaleíne | incolor até pH 8,2 | violeta desde pH 10 |
| Ba2+ | SO42- | 6C6H12O6 | U |
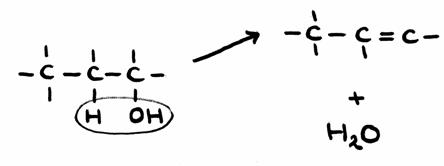
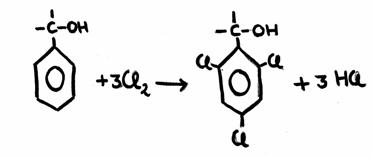
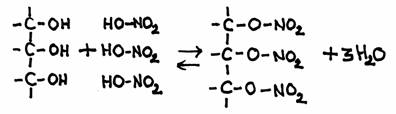
| etano | etanol | etanal | etoxietano | etiletanoato | metano |
|
ambos
os átomos C são -3 |
um C é -3
e outro C é -1 |
um C é -3
e outro é +1 |
dois C's são -3
e outros dois são -1 |
dois C's são -3,
um é-1 e um é +3 |
o C é -4 |
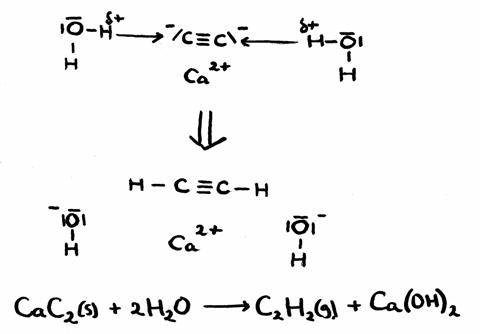
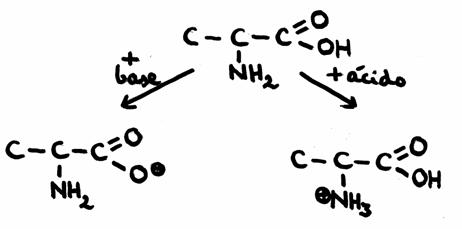
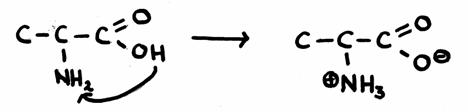
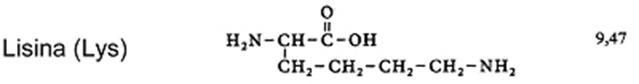
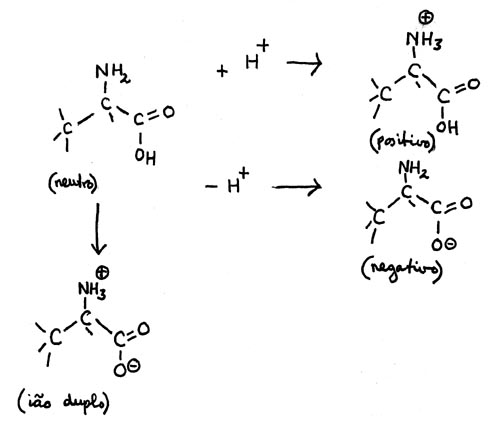
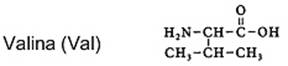
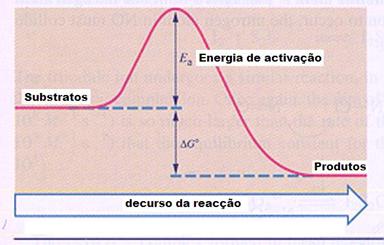
| sítio | enzimas | pH-óptimo |
| Na saliva | amilase e maltase | 6,6 |
| No estômago | peptase, rennase | 1,5 - 4 |
| No pâncreas | amilase, maltase, lipasse, tryptase, polipeptidase | 6,6 - 9 |
| Nos intestinos | maltase, sacarase, lactase, ereptase | 6,6 – 8,5 |