Waterconstante Kw
Autoprotolyse van water
In wateroplossingen zijn altijd watermoleculen in ongelooflijke hoeveelheden, die voortdurend met elkaar in contact zijn.
Elk watermolecuul heeft de (zwakke) neiging om protonen af te staan en op te nemen; tijdens zo'n ontmoeting kan dan het volgende gebeuren:
Let er op dat de beide ionen H3O+ en OH- in gelijke hoeveelheden worden gevormd. Het waterevenwicht kan alleen bestaan in waterig milieu en ligt heel ver naar één kant (de kant van ongesplits water), dus met weinig producten. De evenwichtsconstante zal dus klein zijn.
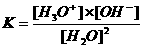

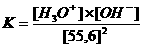

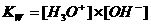
In neutrale waterige oplossingen bij 25ºC, gebeurt het volgende:
Van elke MOL watermoleculen (dat zijn er 6 x 1023) zullen er "slechts" 6 x 1016 een proton vangen en tegelijkertijd zullen eenzelfde hoeveelheid andere watermoleculen een proton afstaan.
Dus, in water van 25ºC:
[H3O+] = [OH-] = 10-7 mol/dm3
ofwel:
pH = pOH = 7
Kw (de evenwichtsconstante van de autoprotolyse) = K x (55.6)2 = [H3O+] x [OH-] = 10-14 mol2/l2
De autoprotolyse van water is een endotherm proces. Bij verwarming zullen de ionenconcentraties toenemen.
Zuiver en neutraal kokend water (met een temperatuur van 100oC) heeft dan geen pH=7
Leg uit of en waarom deze bewering waar of onwaar is.
Hetzelfde nog wat anders benaderd, autoprotolyse van water
Kw Waterconstante
Water zelf is een zwak amfolyt, dus een zeer zwakke base én een zeer zwak zuur.
Als er in water geen andere stoffen zijn opgelost, dan is de pH van dat water bij 25 graden precies 7 en ook de pOH = 7.
Bij het waterevenwicht (H2O + H2O H3O+ + OH-) behoort uiteraard ook een evenwichtsvoorwaaarde K:
H3O+ + OH-) behoort uiteraard ook een evenwichtsvoorwaaarde K:
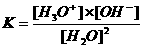
De waterconcentratie is constant = ±55,5 mol/l is
De watersplitsing verandert daaraan praktisch niets.
K.[H2O]2 = [H3O+].[OH-] K·55,5 = Kw = 10-7·10-7 = 10-14
K·55,5 = Kw = 10-7·10-7 = 10-14
Kw noemt men de waterconstante en is bij 25°C : 10-14
Zoals alle evenwichtsconstanten is ook de waterconstante alleen afhankelijk van de temperatuur.
De bovenstaande formules kun je ook m.b.v. p-waarden opschrijven:
pKw = pH + pOH
of in getallen:
pKw = 14 = 7 + 7
Als de pH en de pOH aan elkaar gelijk zijn, dus de [H3O+] en de [OH-] zijn aan elkaar gelijk, dan is de oplossing neutraal.
Omdat Kw een constante is (dus pKw ook) moeten pH en pOH samen altijd 14 zijn
bijvoorbeeld: pH = 5 en pOH = 9. [let op: alleen bij kamertemperatuur!]
Als de pH groter wordt, dan wordt de pOH kleiner en v.v.
Autoprotolyse van water
In wateroplossingen zijn altijd watermoleculen in ongelooflijke hoeveelheden, die voortdurend met elkaar in contact zijn.
Elk watermolecuul heeft de (zwakke) neiging om protonen af te staan en op te nemen; tijdens zo'n ontmoeting kan dan het volgende gebeuren:
| H2O | + | H2O | H3O+ | + | OH- | ΔH | > 0 | ||
|
|
|
|
|
|
| |
Let er op dat de beide ionen H3O+ en OH- in gelijke hoeveelheden worden gevormd. Het waterevenwicht kan alleen bestaan in waterig milieu en ligt heel ver naar één kant (de kant van ongesplits water), dus met weinig producten. De evenwichtsconstante zal dus klein zijn.
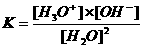


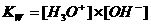
In neutrale waterige oplossingen bij 25ºC, gebeurt het volgende:
Van elke MOL watermoleculen (dat zijn er 6 x 1023) zullen er "slechts" 6 x 1016 een proton vangen en tegelijkertijd zullen eenzelfde hoeveelheid andere watermoleculen een proton afstaan.
Dus, in water van 25ºC:
[H3O+] = [OH-] = 10-7 mol/dm3
ofwel:
pH = pOH = 7
Kw (de evenwichtsconstante van de autoprotolyse) = K x (55.6)2 = [H3O+] x [OH-] = 10-14 mol2/l2
De autoprotolyse van water is een endotherm proces. Bij verwarming zullen de ionenconcentraties toenemen.
Zuiver en neutraal kokend water (met een temperatuur van 100oC) heeft dan geen pH=7
Leg uit of en waarom deze bewering waar of onwaar is.
Hetzelfde nog wat anders benaderd, autoprotolyse van water
Kw Waterconstante
Water zelf is een zwak amfolyt, dus een zeer zwakke base én een zeer zwak zuur.
Als er in water geen andere stoffen zijn opgelost, dan is de pH van dat water bij 25 graden precies 7 en ook de pOH = 7.
Bij het waterevenwicht (H2O + H2O
 H3O+ + OH-) behoort uiteraard ook een evenwichtsvoorwaaarde K:
H3O+ + OH-) behoort uiteraard ook een evenwichtsvoorwaaarde K:
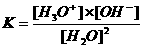
De waterconcentratie is constant = ±55,5 mol/l is
De watersplitsing verandert daaraan praktisch niets.
K.[H2O]2 = [H3O+].[OH-]
 K·55,5 = Kw = 10-7·10-7 = 10-14
K·55,5 = Kw = 10-7·10-7 = 10-14
Kw noemt men de waterconstante en is bij 25°C : 10-14
Zoals alle evenwichtsconstanten is ook de waterconstante alleen afhankelijk van de temperatuur.
De bovenstaande formules kun je ook m.b.v. p-waarden opschrijven:
pKw = pH + pOH
of in getallen:
pKw = 14 = 7 + 7
Als de pH en de pOH aan elkaar gelijk zijn, dus de [H3O+] en de [OH-] zijn aan elkaar gelijk, dan is de oplossing neutraal.
Omdat Kw een constante is (dus pKw ook) moeten pH en pOH samen altijd 14 zijn
bijvoorbeeld: pH = 5 en pOH = 9. [let op: alleen bij kamertemperatuur!]
Als de pH groter wordt, dan wordt de pOH kleiner en v.v.
- Door toevoeging van zuur wordt de [H3O+] groter, dus de pH <.
- Door toevoeging van base wordt de [OH-] groter, dus de pOH <.