Quanto maior a distância do núcleo para a zona exterior, mais fraca a força de atracção pelas partículas negativas.
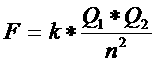
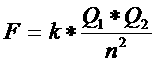

|
1. A REDE
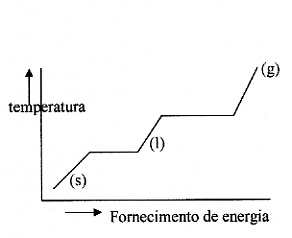
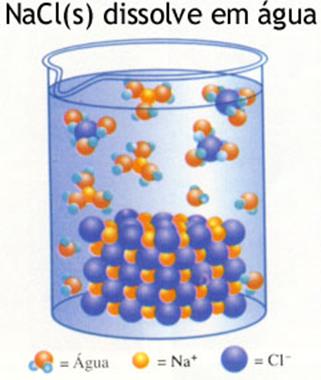
Quais as forças dentro da rede do sólido? Fundir implica a destruição da rede e uma rede forte funda dificilmente. A força duma rede iónica depende em grande parte das cargas e dos raios iónicos. Uma rede de CaO (com cargas 2+ e 2-) vai fundir mais dificilmente do que a rede de NaCl (cargas 1+ e 1-). Iões pequenos (distância interiónica é menor) criam redes mais fortes. Normalmente, os sais têm pontos de fusão altos. As redes metálicas também dependem das cargas (quantos electrões livres, carga dos iões) e da distância entre as partículas. Existem grande diferenças entre os metais: Em geral, os metais têm redes fortes e, consequentemente, pontos de fusão altos. Alguns excepções são: Mercúrio (l), Chumbo, Estanho, Lítio, Sódio, Potássio não têm redes muito fortes. Extremamente fortes são as redes de Cromo, Wolfrámo e Vanádio (veja a tabela V) |
|
2. AS FORÇAS VANDERWAALS Nas redes molecularesexistem forças VanderWaals que dependem de:
|
| Na+ | Cl- | Na+ | Cl- | Na+ |
| Cl- | Na+ | Cl- | Na+ | Cl- |
| Na+ | Cl- | Na+ | Cl- | Na+ |
| Cl- | Na+ | Cl- | Na+ | Cl- |
| Na+ | Cl- | Na+ | Cl- | Na+ |
| Cl- | Na+ | Cl- | Na+ | Cl- |