Sacarídeos / glicídeos / açúcares
Exercício 18
Em certos païses fala-se de carbo-hidratos (são os sacarídeos).
"O nome 'carboidratos' baseia-se num mal-entendido científico antigo."
explique o malentendido.
Classificação simples dos sacarídeos:
- Mono-sacarídeos: glicose, frutose, galactose(C6H12O6)
- Di-sacarídeos: sacarose (açúcar), lactose, maltose (C12H22O11)
- Poli-sacarídeos: amido, amilose, celulose( (C6H10O5)n)
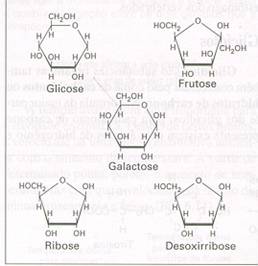
monosacarídeos
Estruturas:
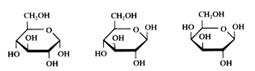
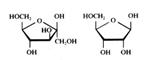
Glicose α- e β-Galactose Frutose Ribose
mais uma vez:
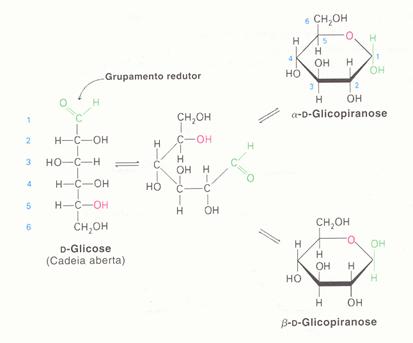
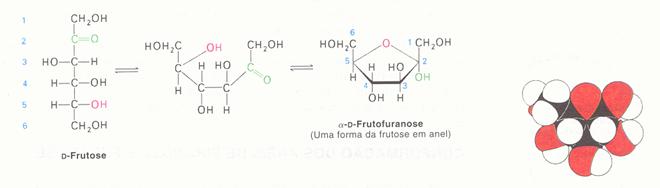
Os monosacarídeos podem se encontrar de forma cíclica (veja acima) ou de forma linear.
Como se vê na imagem, o glicose pode se encontrar em dois tipos de forma cíclica.
A estrutura linear é oxidável com um oxidante fraco:
Ag+ (reagente de Tollens), ou com Cu2+(reagente de Fehling)
A estrutura cíclica pura oxida-se dificilmente, mas uma vez que as duas estruturas (linear e cíclica) se encontram num equilíbrio químico, oxida-se a estrutura linear, o equilíbrio desloca-se para formar mais linear.
Afinal, toda forma cíclica desaparece.

Exercício 19
Estude bem as duas imagens em seguida: glucose e frutose existem em duas formas, linear e cíclica, e as duas formas em meio aquoso ficam sempre em equilíbrio. Apenas a estrutura linear tem o próprio grupo para oxidar (grupamento redutor).
Explique claramente porque é que no processo redox não só a estrutura linear desaparece, mas também a parte cíclica.
Disacarídeos
Maltose Sacarose Lactose
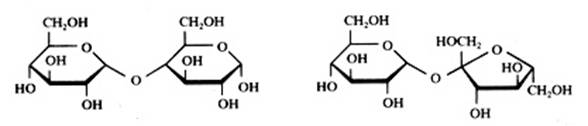
Sacarose não é oxidável com Ag+ ou com Cu2+.
Maltose e lactose são oxidáveis com Ag+ ou com Cu2+.
Exercício 20
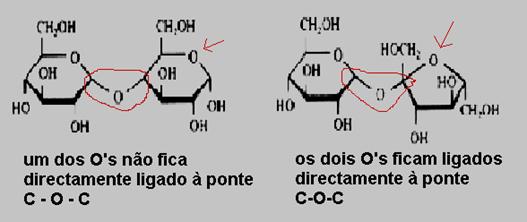
A oxidabilidade da estrutura cíclica depende do lugar do O no anel.
Se uma das ligações C - O no anel pode-se abrir facilmente (formando a estrutura linear), oxidação é fácil.
Analise, com ajuda das estruturas indicadas, porque é que certos anéis não e outros sim podem abrir.
polisacarídeos
Amido não é oxidável com Ag+ ou com Cu2+.
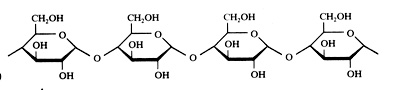
O amido tem uma estrutura 'hélice / hélix' que se pode corar com iões I3-
 ou
ou

Exercício 21
Iodo, sendo uma substância bastante apolar, não dissolve em água, mas sim em água com o sal iodeto de potássio. Explique.
Reagente de Fehling
CuSO4(aq) + 2NaOH(aq)  Cu(OH)2(s) + Na2SO4(aq)
Cu(OH)2(s) + Na2SO4(aq)
Cu(OH)2(s)  Cu2+ + 2OH-(equilíbrio 1)
Cu2+ + 2OH-(equilíbrio 1)
Cu2+ + e-  Cu+
Cu+
Juntar a substância tartrato de sódio vai roubar os iões de Cu2+do equilíbrio 1, assim desaparece o precipitado Cu(OH)2 e surge uma solução transparente de cor azul escura = Reagente Fehlings (RF).
RF tem iões Cu2+ que podem oxidar um redutor (p.ex. o grupo aldeído), captando 1 electrão formando iões Cu+que continuam a reagir até formar um outro precipitado, Cu2O(s) de cor laranja/vermelha.
Assim pode-se provar a presença de monossacarídeos.
Exercício 22
Verdadeiro ou falso?
Para detectar glicose na urina, um método mais específico do que aquele com reagente de Fehling, é o método enzimático com glicose-oxidase.
Resposta 12-22
Aspartame é uma substância aplicada por pessoas que querem evitar a formação de barrigas fortes. Não só põem sacarídeos no café e chá, mas também muitos outros consumíveis (jam, por exemplo) vêm com muito açúcar. Todos os açúcares contêm bastante energia.
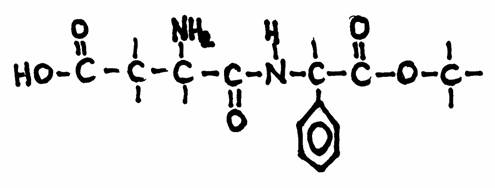
Para uma pessoa que não executa trabalho laboral pesado, esta situação pode criar um corpo forte e gordo, que em geral não é tão bom para a saúde.
Portanto, há pessoas, em particular nos países ricos, que querem combater a gordura e põem substituintes dos açúcares no café, por exemplo: aspartame. É uma substância que as fábricas de cocacola aplicam em cola dieta.
O segredo é o facto de que aspartame entra o corpo sem participar no metabolismo, ou seja, sem criar nenhuma energia ou gordura.
Mas um aviso é necessário: vários substituintes dos açúcares, em grande quantidades, podem criar câncro.
Exercício 23
Examine bem a estrutura de aspartame e classifique todos os grupos funcionais que nela reconhece.
voltar ao curso










 ou
ou

