(hidrólise



| Proteínas são polímeros; | V / F |
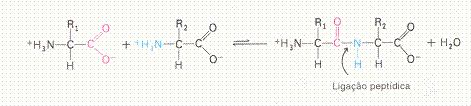
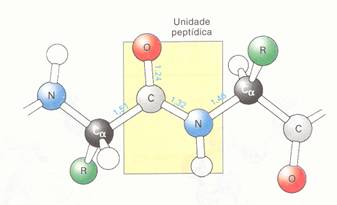
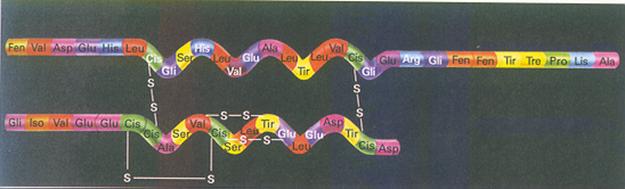
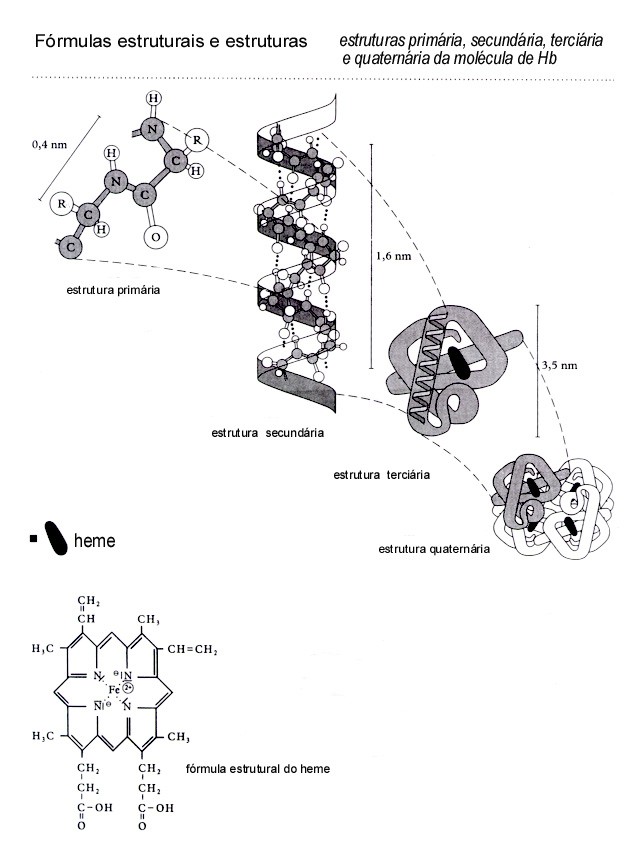
| Proteínas têm uma estrutura primária, i.é. a sequência dos aminoácidos; | V / F |
| Uma estrutura secundária liga várias estruturas primárias; | V / F |
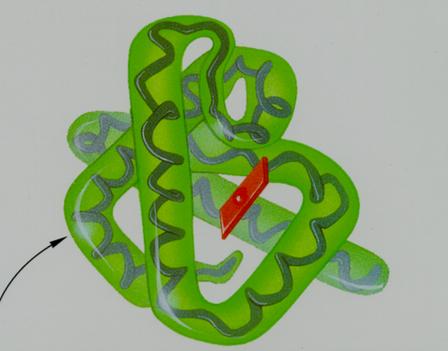
| Uma estrutura terciária é um hélice (hélix); | V / F |
| A estrutura secundária e terciária deve sua estabilidade a ligações/pontes de H e S | V / F |
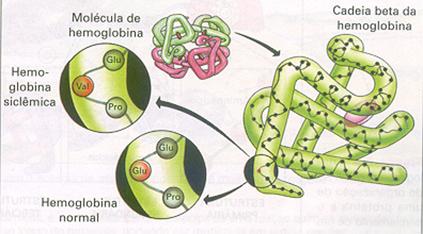
| Proteínas podem ser desnaturadas (reversível ou irreversívelmente), implicando a sua destruição completa com álcool, com ácido, mas não com aquecimento; | V / F |
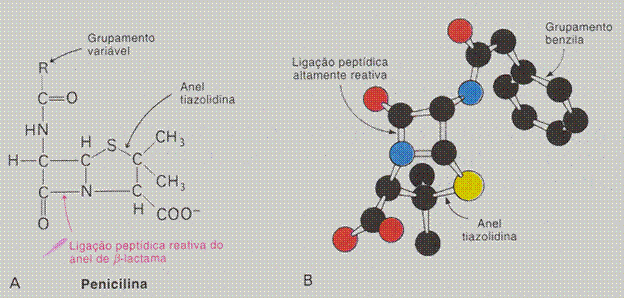
| A estrutura primária não sofre desnaturação; só pode ser destruída num processo químico
(hidrólise |
V / F |
| Existem proteínas estruturais (exemplo: albumina) e proteínas enzimáticas (exemplo: oxidase) | V / F |