2.3 Moléculas
Na nomenclatura das moléculas muitas vezes usamos prefixos:
mono, di, tri, tetra, penta, hexa, hepta, octa, nona, deca
Exemplo:
N2O4 é chamada tetraóxido de diNitrogénio.
O uso destes prefixos limita-se às situações que podem criar confusão.
Exemplo:
O nome óxido de Carbono não chega, porque existem dois óxidos de Carbono diferentes.
CO é chamado monóxido de Carbono e o outro é dióxido de Carbono.
Ligações dum elemento com Hidrogénio, muitas vezes, ficam com nomes tradicionais: amoníaco, água, metano, e outros.
Na química orgânica existe mais um sistema de prefixos:
Meta, eta, propa, buta e em seguida os prefixos conhecidos: penta, hexa etc.
Afinal, existem sais que contêm moléculas de água, incluídas na rede iónica. São sólidos que incluem água. São cristais que contêm moléculas de água e a essas substâncias chamamos: hidratos.
Exemplo:
Sulfato de Cobre(II)pentahidrato e outro exemplo: Na2CO3.10H2O. Aquelas substâncias podemos comprar de forma sólida.
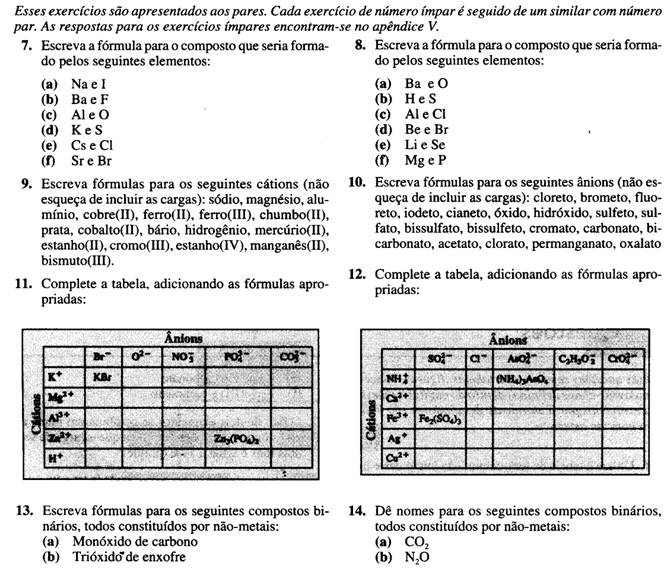
Exercício 12
No livro de tabelas existe uma tabela: "solubilidade dos sais", tabela XI
Procure esta tabela e dá o nome e a fórmula molecular de cada combinação dos iões positivos e negativos.
O cursista é considerado conhecer de cor as fórmulas e nomes desta tabela!!
Exercício 13
Resolve todos os Exercícios em baixo
(vêm do livro "fundamentos de química geral", Hein e Arena, nas páginas 112 e 113)



voltar ao curso



