4. Equilíbrio homogéneo & heterogéneo
No caso de todos os produtos e reagentes que participam no equilíbrio são substâncias homogéneas, chamamos ao equilíbrio também: equilíbrio homogéneo. Quer dizer que cada substância tem uma certa concentração (no caso de soluções) ou pressão (no caso de gases).
O seguinte equilíbrio é heterogéneo:
CaCO3(s)  CO2(g) + CaO(s)
CO2(g) + CaO(s)
Imagine um recipiente fechado com uma quantidade de carbonato de cálcio o que vamos aquecer bastante, até decompor, formando o gás dióxido de carbono e cal viva.
Dentro do recipiente, o gás não pode escapar, fica em contacto com a cal viva. Estes produtos reagem numa reacção inversa, formando carbonato de Cálcio.
No recipiente existe um equilíbrio químico entre dois sólidos (no fundo) e um gás (espalhado homogeneamente no recipiente).
A única substância com uma concentração / pressão é o dióxido de carbono. Os sólidos não têm, e na equação da constante do equilíbrio preenchemos - de modo geral - o valor 1 para substâncias heterogéneas.
Exercício 15
Explique a seguinte expressão matemática com a informação em cima:
Um outro exemplo é a dissociação dum sal insolúvel em água. A palavra 'insolúvel' é, de facto, não muito exacta, porque sempre haverá alguns iões que escapam da rede iónica quando entram em água.
Os produtos (= os iões) reagem formando o sal(s).
O equilíbrio é o seguinte:
CaCO
3(s)

Ca
2+(aq) + CO
32-(aq)
Dos quatro componentes desta mistura, um é o solvente e três participam nas reacções químicas.
Exercício 16
Dos três componentes que participam nas reacções químicas, quais são heterogéneos e quais homogéneos?
Somente os iões (livres) têm uma concentração para preencher a constante do equilíbrio:
5.1 KC e KP
A constante do equilíbrio contem concentrações no caso de ter substâncias dissolvidas homogeneamente. Neste caso adicionamos o C: KC.
Uma outra situação homogénea é o caso de substâncias gasosas em equilíbrio. Neste caso não falamos de concentrações, mas sim de pressão dos gases.
Cada gás numa mistura gasosa contribui à pressão. A pressão (parcial) de cada componente é proporcional com a quantidade daquele gás. Na fórmula da constante de equilíbrio preenchemos os valores das pressões parciais; a fórmula não muda nada na realidade, mas é indicada com KP.
N.B.
- Em soluções homogéneas, usamos KC
- Em caso de gases, usamos KP
- Em caso de misturas heterogéneas (s)+(aq) usamos Ks (veja parágrafo em seguida)
- Por convenção, a concentração dum sólido (substância heterogénea) apanha o valor de 1.
- O valor total do K não depende de mudanças em concentrações, pressão, catalisador.
Só muda em caso de mudar a temperatura do sistema química.
Existem muitos equilíbrios com substâncias bem fortes a um lado e bem fracas ao outro. Sim, as substâncias chegam a equilíbrio e as concentrações ficam constantes, mas muito diferentes: provavelmente, haverá muita substância fraca e pouca substância forte.
Este equilíbrio tem uma extensão estrema para um lado; é muito deslocado para um lado, onde se encontram as substâncias fracas.
Isto reflecte-se de imediato no valor de K:
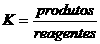
Exercício 17
Quais os valores de K:
- no caso de ter produtos muito fortes e reagentes muito fracos
- no caso de ter produtos muito fracos e reagentes muito fortes
Resposta 08-17
voltar ao curso