1.2 Fórmulas
Na sistemática da química usamos nomes das substâncias, mas também fórmulas de vários tipos:
- Cada elemento tem seu próprio símbolo, são as fórmulas elementares.
É de lembrar que sempre são constituídos por uma letra maiúscula e nem sempre por uma letra minúscula. Ex.: Cu, H, Co, Ar
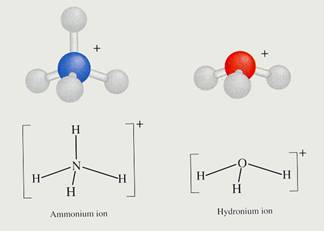
- Depois temos fórmulas iónicas, tanto dos iões simples como dos iões complexos. Sempre vêm com uma carga, escrita ao lado direito em ` cima.
Exemplo: Cu2+, H3O+, Fe3+, NH4+, PO43-, Cl-, etc. etc.
- A fórmula que mostra a proporção mais simples dos elementos participantes é chamada: fórmula empírica. Aplica-se em particular no caso de substâncias iónicas e metálicas. Ex.: NaCl, Cu, CaO, etc.
- A maior parte das substâncias tem uma fórmula molecular, que mostra o número real dos átomos de cada elemento numa
molécula da substância. Ex.: H2O, C2H5OH.
- A fórmula electrónica mostra cada átomo ou ião junto com todos os electrões de valência (trancinhas e/ou pontinhos),
incluindo os electrões compartilhados e não compartilhados.
- E existem as fórmulas estruturais.
Veja o módulo 2, §2.1
N.B. o número 1 não se escreve nas fórmulas. (ex. Na1Cl1 ou Cu1S1O4)
Na prática tem que ser: NaCl ou CuSO4
1.3 Fórmulas estruturais
Cada molécula tem sua forma tridimensional e um bom artista pode desenhar um modelo desta forma.
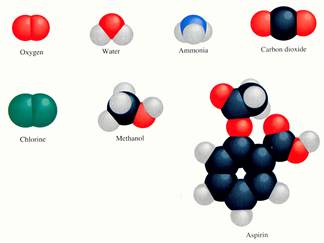
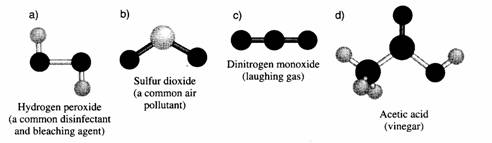
Infelizmente, a maioria dos químicos e professores, estudantes e alunos não são artistas, nem têm tempo para assim desenhar. Além disso, uma fórmula
estrutural mostra mais esquematicamente a constituição das moléculas.
umas regras:
- cada átomo fica com o seu símbolo;
- cada ião fica com a sua carga;
- cada ligação covalente fica com um tracinho (ligação simples), dois trancinhos (ligação dupla) ou três trancinhos (ligação tripla).
- No caso de ter uma escolha, a maior parte dos átomos prefere ligar a átomos dum elemento diferente, com a grande excepção de Carbono, cujos átomos ligam facilmente um a outros átomos de Carbono.
- o átomo de Hidrogénio, ligado à cadeia de Carbono, muitas vezes é deixado fora, ficando só com trancinhas.
No módulo 3 foi tratado a fórmula electrónica que assemelha muito a fórmula estrutural.
De facto, a diferença é a presença de todos os electrões de valência na fórmula electrónica.
A fórmula estrutural somente fica com os pares (tracinhos) partilhados.
Exercício 7
Dá a fórmula estrutural e electrónica de água, de amoníaco e de dióxido de enxofre.
Exercício 8
Uma molécula de ácido sulfúrico tem uma fórmula estrutural.
Elabore uma fórmula estrutural possível.
resposta 04-08
voltar ao curso


