2.1 As fases; (s) (l) (g) (e (aq)
Exercício 15
Falando das fases ou estados físicos das substâncias, oficialmente, o (aq) não pertence às fases. Explique.
No livro de tabelas, tabela VII, podemos encontrar um esquema que mostra modelos de cada fase, em termos de partículas.
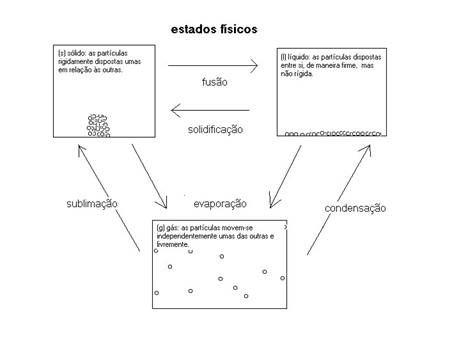
No estado sólido, as partículas encontram-se em posições rígidas, não têm liberdade de movimento, têm falta de mobilidade.
Vibrações sim são possíveis, dependente da temperatura. O movimento aumenta com a temperatura.
As partículas, normalmente, formam padrões regulares (redes) e a substância tem uma estrutura cristalina.
As partículas imóveis causam uma forma definida do sólido.Certos sólidos não são cristalinos, mas amorfos (sem forma), por exemplo: vidro, plástico e gel.
No estado líquido, as partículas têm uma certa mobilidade que depende do carácter das partículas e da temperatura.
Não formam estruturas rígidas, mas, tal como nos sólidos, ficam juntas por razões de atracção. Com certeza, todas partículas no líquido sofrem vibrações.
A mobilidade das partículas dá ao líquido um carácter de fluidez.
No estado gasoso, as partículas ficam todas separadas, cada uma com toda liberdade de se mover.
Há relativamente muito espaço entre as partículas, assim criando a possibilidade de comprimir a substância gasosa.
As partículas exercem (choques com outras superfícies) uma pressão dependente da energia e do número das partículas que constituem o gás.
N.B.
Existe um mau conceito, em particular acerca dos líquidos:
As partículas num líquido – tal como num sólido – ficam muito perto uns com os outros.
A diferença com o sólido é de que as partículas podem mover, não têm uma posição fixa, podem deslocar-se.
As partículas dos líquidos contêm energia cinética demais para ficar na sua posição, mas falta energia para afastar-se umas das outras.
Portanto: um líquido não é coisa entre gás e sólido, mas tem uma densidade tal como um sólido e também não pode ser comprimido.
(aq) usa-se muitíssimo na química, mas não apresenta um estado; sim uma mistura: sempre trata-se aqui duma solução duma substância em água.
NaCl(aq) quer dizer: um solução do sal da cozinha.
Exercício 16
Os processos seguintes são processos reais?
Explique a sua resposta por descrever o acontecimento:
- H2O(l)
 H2O(g)
H2O(g)
- CuSO4(aq)
 CuSO4(s)
CuSO4(s)
- Na2CO3.10H2O
 Na2CO3(l)
Na2CO3(l)
N.B.-1
Mudanças de fase, de modo geral, não são consideradas reacções químicas;
mas cuidado, nem sempre é possível distinguir tão bem entre fenómenos químicos e físicos.
N.B.-2
Também existem substâncias que não chegam a um ponto de fusão ou de ebulição.
Antes de atingir o ponto de ebulição, começam já a decompor.
Exercício 32
Dá, com palávras, as equações das 'reacções':
- "fundir e ferver" açúcar
- decomposição de açúcar
Evaporação
Exercício 33
afirmação: Durante a evaporação do sólido I2 formam-se átomos de iodo.
É verdadeira ou falsa? Explique
Quando as partículas dum líquido recebem energia, ou mesmo as partículas numa rede dum sólido, por exemplo por aquecimento,
aumentam movimento e vibrações das mesmas. A um certo ponto,as partículas ficam com tanto movimento que as forças de atracção
já não conseguem ligar as partículas.
As forças intermoleculars já não chegam para manter as partículas juntas.
Separam-se umas das outros, afastam-se completamente, assim formando o estado gasoso.
Naquele estado gasoso as partículas encontram-se de vez em quando, chocam também com as paredes do recipiente (se houver),
mas não consequem ficar juntas.
No caso de perder energia (arrefecer) ou sob influência de grande pressão, as partículas
podem voltar para o estado líquido ou sólido.
voltar ao curso
