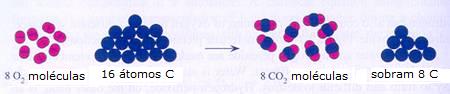

| Regras principais na resolução de cálculos estequiométricos | |
| 1 | Elaborar uma equação acertada da reacção. Incluir os estados físicos |
| 2 | Sublinhar as substâncias sobre as quais existem dados ou há perguntas.
Os dados podem surgir directamente ou indirectamente. O cálculo continua somente com as substâncias sublinhadas; as eventuais outras substâncias ficam fora |
| 3 | Nota bem a proporção molar |
| 4 | Transferir, se for necessário, moles para as unidades apropriadas |
| 5 | Introduzir um factor para respeitar as quantidades reais, assim terminando o cálculo |
| 1 | a equação certa: N2(g) + 3H2(g)
|
| 2 | temos que calcular as quantidades dos produtos e sabemos a quantidade de produto, portanto, todas as substâncias ficam no cálculo:
N2(g) + 3H2(g) |
| 3 | A proporção molar dos reagentes e produto é: 1 : 3 : 2 ou melhor dizer:
Um mol de nitrogénio reage com três moles de hidrogénio e forma dois moles de amoníaco. |
| 4 | 3 mol hidrogénio reage com 1 mol nitrogénio e formam 2x17 = 34 gramas de amoníaco
dos 1000 gramas do produto, 978 gramas são amoníaco puro; portanto, formam-se 978 g amoníaco puro em vez de 34 gramas. O famoso factor será: 978/34 = 28,8. |
| 5 | em curto: 28,8x3 = 86,4 mol hidrogénio reagem com 28,8x1 = 28,8 mol nitrogénio e formam28,8 x 34 = 1000 gramas 97,8% amoníaco. |