3.2 Indirecta e espontânea: Pilhas e baterias; células químicas
Reacções redox espontâneas normalmente decorrem em contacto directo, mas podem também decorrer a distância às superfícies dos eléctrodos.
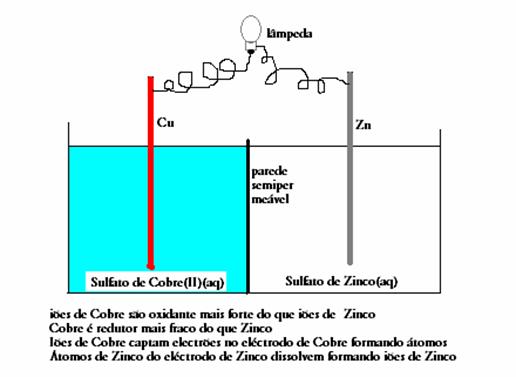
Por exemplo o caso anterior da célula Cu/Zn. O Zn da barra dissolve espontaneamente, formando iões Zn2+,
deixando dois electrões na barra de Zinco (este cátodo torna-se negativo). Os iões Cu2+ captam electrões da barra de cobre
(e tornando assim o ánodo positivo) enquanto os átomos formados de Cu ficam parte da barra de cobre (o ánodo).
Nas células químicas (ou elementos galvánicos) realiza-se uma mudança espontânea de energia química em energia eléctrica.
Portanto, aqui reagem substâncias fortes (redutor e oxidante) via eléctrodos (indirectamente) formando produtos mais fracos.
Os electrões são transferidos por fio externo: a corrente eléctrica.
Todos conhecemos as aplicações dos elementos galvánicos: pilhas e baterias.
Exercício 34
Nas céluas químicas sempre devem-se separar os espaços electródicos. Explique esta necessidade.
Considere o seguinte equilíbrio nos dois eléctrodos:
(no ánodo) red 1 (Cu)  ox 1 (Cu2+)+ electrões (a)
ox 1 (Cu2+)+ electrões (a)
(no cátodo) ox 2 (Zn2+)+ electrões  red 2 (Zn) (b)
red 2 (Zn) (b)
No momento que uma bateria ou uma pilha fornece corrente eléctrico (fluxo de electrões),
estes electrões vêm do eléctrodo negativo e mudam para o eléctrodo positivo, externamente.
No equilíbrio (a) domina a formação de Cu (equilíbrio tende deslocar-se para esquerda). Logo que electrões chegam a este polo,
o equilíbrio pode deslocar-se mais para esquerda, etc.
No equilíbrio (b) domina a formação dos iões de Zinco. Loge que desaparecem mais electrões, este equilibrio tende mudar ainda mais para esquerda.
Estes dois processos continuam bastante tempo, até um dos reagentes (Cobre ou iões de Zinco) está gasto. A bateria já não tem força.
A pilha contém um oxidante e um redutor (fortes) que não podem ter contacto directo. A transferência dos electrões, do redutor para o oxidante,
deve realizar-se externamente, indirectamente, através dos eléctrodos e fios eléctricos.
Exercício 35
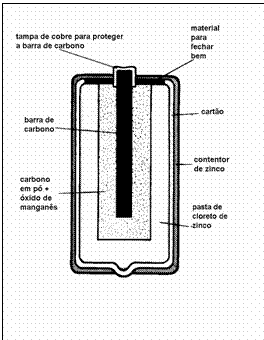
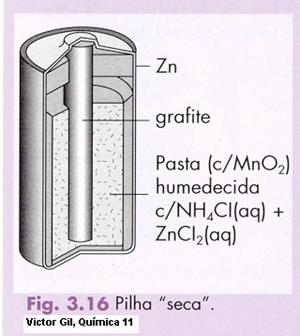
Compare as duas imagens da mesma pilha e explique as diferenças nas descrições.
Exercício 36
Explique como é que a bateria dos carros (PbSO4//PbSO4/PbO2)funciona e como será possível recarregá-lo.
Exercício 37
Consultanto a tabela REDOX, escholhe o oxidante e redutor com força suficiente que, na prática, possam servir numa célula química, num elemento galvánico.
Consulte nas aulas laboratoriais o docente para conhecer a eventual possibilidade de contruir esta célula.
voltar ao curso