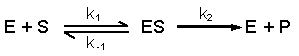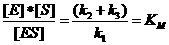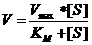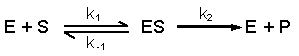Michaelis Menten (veja também o anexo)
Cada reacção tem sua própria velocidade V com o seu próprio constante de velocidade k
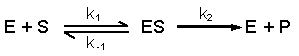
Com três pressupostos que criam uma situação ideal / óptima, pode-se afirmar que a velocidade chega à velocidade máxima Vmax

Os três pressupostos são:
- um estado estationário (steady state) no qual a concentração do intermediário ES não muda; a formação do complexo ES acontece com a mesma velocidade do que a degradação do mesmo.
- Toda enzima presente participa;
- O sistema encontra-se num ambiente óptima (saturação com S, o melhor pH, a melhor temperatura); assim a velocidade V chega à velocidade máxima Vmax
a velocidade da formação do intermediário ES:
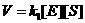
a velocidade da quebra do intermediário ES (para dois lados):
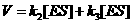
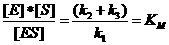
KM é o constante de Michaelis
Exercício 40
Explique como chegar a esta expressão a partir do pressuposto 1.
Resposta 12-40
KM mostra a afinidade pela enzima ao substrato; um KM baixo implica muito ES, portanto, muito substrato S;
isto é: pequeno KM implica velocidade maior.
A relação entre a velocidade da reacção e KM pode-se ler na equação de Michaelis Menten:
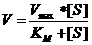
Os valores de KM podem variar de 0 até milhares
Exercício 41
Leia bem a tarefa prática laboratorial, tente imaginar esta prática e dá o seu comentário:
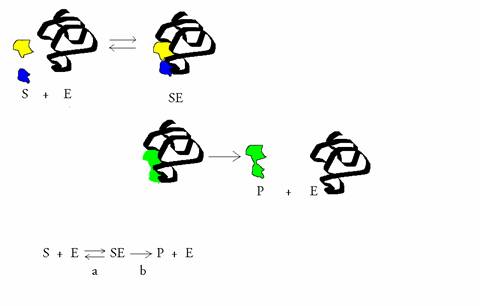
“Divida-se um extracto neutro (pH=7) da mucosa gástrica em duas partes iguais (A e B).
Acidifica-se a parte A com HCl até atingir o pH 2: esta mistura já não mostra actividade de degradação proteica.
Dilui-se a parte B com um volume igual de água: esta mistura não mostra nenhuma actividade.
Tratam-se ambas as partes, A e B, com base, até atingir um pH 8,5: não há nenhuma actividade enzimática de degradação proteica.
Acidificam depois as duas partes de pH 8,5 para atingir pH 2: Só parte B mostra actividade de degradação proteica.”
Exercício 42
Tenta compreender a seguinte descrição duma experiência, junto com os gráficos:
"Na comparação das enzimas, determinam-se os parâmetros de Vmax e Km , medindo a velocidade da reacção (V) em função da concentração do substrato [S]."
Neste caso mede-se, para uma quantidade padrão de hexocinase ou glicocinase, a velocidade da formação (V) de GlucoseFosfato (o produto G6P) em função da concentração de glicose (S).
Os resultados mostram que as Vmax das duas enzimas são iguais (formam-se ±100 nmol G6P por minuto), mas os Km diferem bastante:
Km da hexocinase = 0,1 mM, Km da glicocinase = 10 nM (factor 100)."
Considere mais uma vez o seguinte equilíbrio, com um intermediário SE:
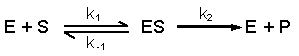
o constante de Michaelis
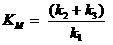 mostra a afinidade da enzima para o substrato
mostra a afinidade da enzima para o substrato
a equação de Michaelis-Menten
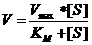 mostra a relação entre KM e a velocidade da reacção
mostra a relação entre KM e a velocidade da reacção
Existem vários tipos de inibição das enzimas:
- Inibição pelo produto
- Inibição por drogas
- Inibição alostérica
voltar ao curso