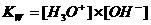Zuur-Base Evenwicht
Kw
Autoprotolyse van water
In een watermilieu heb je altijd ongelooflijk veel watermoleculen die voortdurend met elkaar in botsing zijn. Nu heeft het watermolecuul de (heel zwakke)neiging om protonen af te staan, maar ook om protonen op te nemen (water is dus amfoteer)
Bij botsing tussen twee watermoleculen zal het volgende kunnen gebeuren:
H2O |
+ |
H2O |
 |
H3O+ |
+ |
OH- |
|
|
ΔH > 0 |
| zwakke base |
|
zwak zuur |
|
sterk zuur |
|
sterke base |
|
|
|
Let op: de twee ionen vormen zich in gelijke hoeveelheden.
Het waterevenwicht bestaat uitsluitend in watermilieu, ligt sterk aan één kant en heeft een evenwichtsconstante:
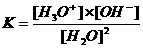 →
→
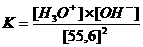 →
→
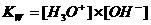
In neutrale wateroplossingen met een temperatuur van 25ºC gebeurt het volgende:
Van elke MOL watermoleculen (dat zijn er 0,6 x 1023) zullen "slechts" 6 x 1016 watermoleculen echt een proton opnemen en dus ook 6 x 1016 zullen een proton afstaan.
In water van 25ºC zal de concentratie [H3O+] = [OH-] = 10-7 mol/dm3 of: pH = pOH = 7
Kw (autoprotolyseconstante) = K x (55.6)2 = [H3O+] x [OH-] = 10-14 mol2/l2
Die autoprotolyse van water is een endotherm proces.
Bij hogere temperaturen vormen zich meer ionen, hun concentraties worden hoger (bijvoorbeeld 10-6 mol/dm3 in plaats van 10-7 mol/dm3).
De waarde van Kw verandert in dit geval van 10-14 naar 10-12.
Gegeven: In kokend zuiver water is de waarde van de pH niet gelijk aan 7.
Toch is kokend water nog steeds een neutrale stof


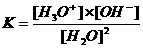 →
→
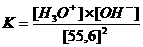 →
→