Bezitten één of meer carboxylgroepen (-COOH) (hierover veel meer in module 11 = koolstofchemie)
De carboxylgroep kan een ion H+ afgeven, oftewel, de carboxylgroep is volgens de definitie een zuur (een zwak zuur meestal)
N.B. Let op:
Fenol (benzeen met een hydroxylgroep -OH) is een vloeistof met een zwak zuur karakter.
Hydroxylgroepen vinden we meestal bij alkoholen en zijn normaal helemaal niet zuur van karakter. Maar die van fenol is wel in staat H+ van die hydroxylgroep af te geven.
Dit bijzondere feit is te danken aan de aanwezigheid van die benzeenring (met de zes vrije elektronen in de ring). De afwezigheid van dat proton, en dus de aanwezigheid van O- aan de ring, versterkt de vrijheidsgraad van deze zes (+1) elektronen wat het geheel nog stabieler maakt dan het al was.
Afsplitsing van H+ versterkt dus de stabiliteit van de structuur, vandaar dat (zwak) zure karakter.
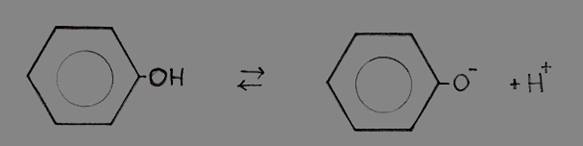
of
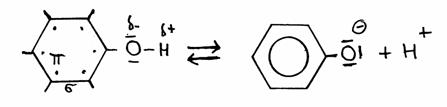
Fenolfenolaat + H+
Het extra elektron van fenolaat gaat meedoen in de vrije beweging van de zes elektronen van de ring en stabilizeert zo het fenolaat.
Dit zijn de niet-organische zuren die het element zuurstof bevatten.
Deze zuren kunnen in naamgeving variëren, afhankelijk van het minimale en maximale aantal zuurstofatomen in het molecuul Bijvoorbeeld:
H2SO3 en H2SO4
fosforzuur = H3PO4
Als de formule niet H3PO4 is, maar H3PO3, dan krijgt dit zuur de naam: fosforigzuur.
| Zuur | zuurrest | voorbeeld | voorbeeld |
| onder(hypo).......igzuur | onder(hypo).......iet | hypochlorigzuur | hypochloriet |
| ......igzuur | ......iet | chlorigzuur | chloriet |
| ......zuur | ......aat | chloorzuur | chloraat |
| (hy)per.......zuur | (hy)per.......aat | (hy)perchloorzuur | (hy)perchloraat |
N.B.
Niet alle zuurstofhoudende zuren hebben alle vier mogelijkheden
Allemaal hebben ze de normale '...zuur' en '...aat'
Sommige hebben ook '...igzuur' en ...iet'
Hypo en hyper zijn tamelijk uitzonderlijk
De meest bekende van dit type is HCl, zoutzuur
De formule begint altijd met H, direct gevolgd door een ander element, zonder zuurstof dus (HBr, HI, HCN, etc.)
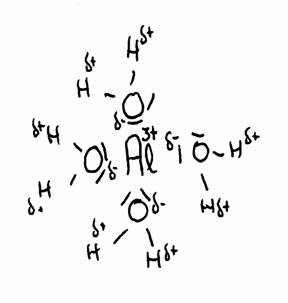
Het meest beroemde voorbeeld is het aluminium-ion in water opgelost, maar er zijn er veel meer.
Kationen zijn vrijwel altijd meerwaardige gehydrateerde positieve metaalionen:
Al(H2O)63+, Cu2+, Fe2+ of Fe3+, en nog veel meer andere, zijn altijd in water gehydrateerd.
De tekening laat de aantrekking zien tussen Al3+ en het δ- deel van zuurstof en het δ+ deel van waterstof.
De watermoleculen (in totaal 6) omgeven het 3+ ion van Aluminium omdat dit positieve ion de δ- van water om zich heen trekt.
Zodoende wordt de afstand tussen 3+ en δ+ steeds korter en daarmee de afstoting tussen 3+ en δ+ steeds sterker.
Het gevolg is dat de H min of meer kan worden afgestoten. Er kan afgifte zijn van H+-ionen, en dat noem je: een zuur karakter.
Ook een ammonium-ion kan een proton afgeven en is dus een (zwak) zuur.
Normaal zullen negatieve ionen H+ ionen willen aantrekken, en dan noem je het een base.
Toch kunnen bepaalde negatieve ionen als zuur dienen, dus H+ afgeven. Bijvoorbeeld: HCO3-.