De veranderingen bij een chemische reactie worden aangeduid met een pijl:  ,
de reagerende stoffen ervoor, de producten erna.
,
de reagerende stoffen ervoor, de producten erna.
Reagentia
 Producten
(reactievergelijking)
Producten
(reactievergelijking)
Je kunt soms de reactie in woorden opschrijven (zoals: calcium met water  kalk en waterstof),
kalk en waterstof),
maar normaal gebruiken we in de scheikundige symbolen voor elk deelnemend deeltje en is de molverhouding te zien (de reactie is kloppend) evenals de aggregatietoestand (de fase).
Het totaal aantal deelnemende elementaire deeltjes (atomen en ionen, maar ook protonen, neutronen en elektronen) verandert niet tijdens een reactie.
Je begint de vergelijking natuurlijk met de juiste formules, maar als die eenmaal staan, dan moet je er voor zorgen dat het aantal deeltjes per element aan beide kanten van de pijl gelijk is. Er verdwijnen namelijk geen atomen tijdens een normale scheikundige reactie.
Met "coŽfficiŽnten" maken we de vergelijking kloppend: bijvoorbeeld, 2 moleculen van dit reageren met 3 ionen van dat enzovoort.
Die coŽfficiŽnten geven: de molverhouding.
Daarnaast moet je ook altijd even kijken naar de elektrische lading aan beide kanten. Ook die mag niet veranderen. Als er toch verschillen zijn, dan moet dat in orde gemaakt worden.
Algemeen:
- Je zorgt voor de juiste formules van de deelnemende stoffen;
- Je maakt de vergelijking kloppend met de coŽfficiŽnten;
- Je voegt de aggregatiestoestanden toe aan elke stof: (s) (l) (g) (aq); [(aq) is eigenlijk geen echte fase]
- Van ionen schrijf je normaal ook de ionenformules op in de vergelijking.
Alleen als er gerekend moet worden (reactieberekeningen), dan is het handig om de empirische formules te gebruiken, ook voor stoffen die uit ionen zijn opgebouwd.
Opdracht 9
Geef de vergelijkingen van de volgende reacties en geef de molverhouding van de reagentia.
- De fotosynthese
- Calcium reageert met water en vormt 'gebluste kalk' en een gas.
Geef hier twee reacties: ťťn in ionen en ťťn in empirische formules.
- De neerslagvorming bij het mengen van natriumhydroxide(aq) en koper(II)sulfaat(aq). (ook met ionenformules en met empirische formules)
- De vorming van amoniakgas uit de elementen
- De ontleding van water
- Krijt met zoutzuur
- De vorming van ijzer(II)sulfaat uit de elementen
- De verbranding van aardgas
- De verbranding van benzine
- De afgifte van twee elektronen door een atoom Calcium
Als het kan, beeld dan de reactie ook uit in modellen.
Heel speciaal is de kernreactievergelijking. Daarin veranderen namelijk elementen, wat nooit gebeurt bij normale chemische reacties.
Toch gelden de normale regels van aantal deeltjes en de lading aan elke kant van de pijl net zo voor de kernreacties.
Voorbeelden:
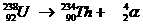
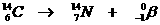
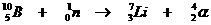
Opdracht 10
De regels voor gewone reactievergelijkingen gelden ook voor kernreactievergelijkingen.
Controleer dat.
terug naar start