unimoleculaire reacties
Er bestaan chemische reacties waarbij de deeltjes (moleculen bijvoorbeeld) - eenvoudigweg omdat ze voldoende energie bezitten - uit elkaar vallen, ontleden in een ontledingsreactie.
In dat geval hangt de reactiesnelheid niet af van de aanwezigheid van andere deeltjes.
Dat zijn reacties van de eerste orde (unimoleculair) wat wil zeggen: de deeltjes hoeven niet te botsen met andere deeltjes om tot reactie te komen. Ze kunnen zich spontaan delen in verschillende onderdelen.
Een voorbeeld hiervan is de ontleding van Ozon.
Bij een unimoleculaire reactie hoort onderstaande grafiek met de zgn. halveringstijd.
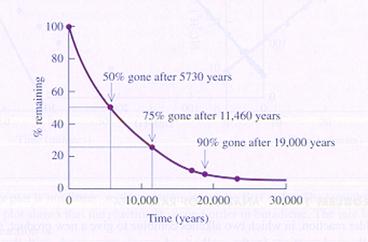
Een ander voorbeeld van een unimoleculaire reactie is de ontleding van N2O4.
Met voldoende energie zal het molecuul zich verdelen in twee delen (NO2).
Deze reactie bestaat uit slechts één stap.
