





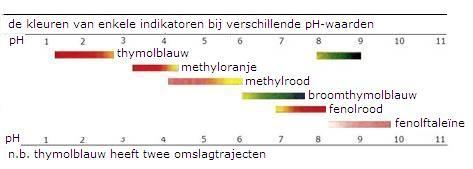
| Om het omslagpunt te kunnen waarnemen, is meestal een indicator nodig | |
| Bij een zuurbasetitratie: | een zuurbase-indicator |
| Bij een redoxtitratie: | een redox-indicator |
een zwak organisch zuur |
een zwakke organische reduktor |
HIn |
RedIn |
HIn andere kleur dan In- |
RedIn andere kleur dan OxIn |
De kleur van het HIn of In- |
De kleur van RedIn of OxIn |
is pas duidelijk te zien als het evenwicht voldoende links of rechts ligt. |
|
De kleur die een indicator aanneemt hangt af van de omgeving:
In een zuur milieu(of in een reducerend milieu) liggen bovenstaande evenwichten naar links en overheerst dus de kleur van het HIn (of RedIn). Per indicator kan dit sterk verschillen. |
|
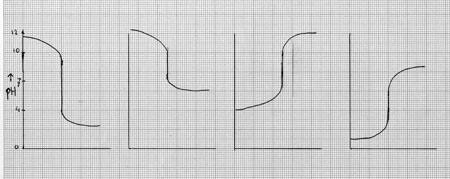
| titratie van sterk zuur met sterke base: | pH = 7 |
| titratie van sterk zuur met zwakke base: | pH < 7 |
| titratie van zwakzuur met sterke base: | pH > 7 |