1.3 Structuurformules
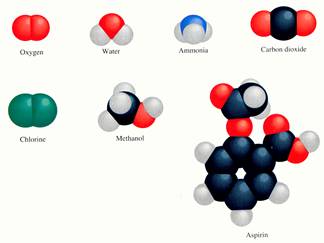
Elk molecuul heeft zijn eigen driedimensionale vorm (ruimtelijk) en alleen een goede kunstenaar kan modellen daarvan tekenen.
Niet alle scheikundigen, docenten, studenten of leerlingen zijn grote artiesten of kunstenaars en ze hebben ook niet altijd tijd om zulke mooie modellen als in het voorbeeld te tekenen.
Nou, dat hoeft ook niet; een structuurformule kan ook op een veel meer schematische manier de samenstelling van een deeltje laten zien.
hieronder een paar regeltjes die meestal geldig zijn:
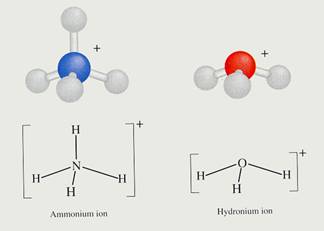
- Elk atoom behoudt zijn eigen symbool;
- elk ion behoudt zijn eigen lading;
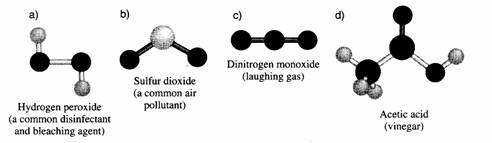
- elke covalente binding zien we als een streepje (enkelvoudige binding), twee streepjes (dubbele binding)
of drie streepjes (drievoudige binding).
- Als het atoom het voor het kiezen heeft, dan geeft het de voorkeur aan een koppeling met een atoom van een ander element.
(met grote uitzondering van Koolstof dat juist graag aan zijn eigen soort koppelt).
- een atoom van Waterstof, direct gekoppeld aan een koolstofketen, wordt veelal weggelaten, of je toont alleen een streepje in de
structuurformule.
In module 3 (de cursus "Chemische Bindingen") wordt ook behandeld hoe de electronenformule lijkt op de structuurformule.
Het verschil is de aan- of afwezigheid van de valentie-electronen.
Opdracht 7
Geef de electronenformule van water, van ammoniak en van zwaveldioxide.
Opdracht 8
Het molecuul van zwavelzuur heeft een structuurformule.
Noteer een mogelijke structuurformule van zwavelzuur.
Kies antwoord 04-08
terug naar start