Kijken we in de tabel, dan moeten we concluderen dat water zowel als oxidator en als reductor kan optreden (in beide gevallen zeer zwak).
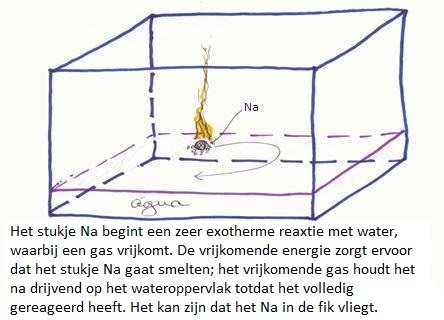
Maar natrium daarentegen is een zeer sterke reductor, dus logisch om te denken dat het water in dit geval als oxidator gaat optreden.
De reductor staat hier lager dan de oxidator, dus de reactie is spontaan.
| Red: | Na | Na+ + e- | |x2 | |
| Ox: | 2H2O + 2e- | H2 + 2OH- | |x1 |
NB: het aantal elektronen moet in beide halfreacties gelijk zijn
2Na + 2H2O
 2Na+ + H2 + 2OH-
2Na+ + H2 + 2OH-
of:
2Na(s) + 2H2O(l)