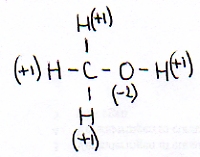Ook in de koolstofchemie komen redoxreacties voor. Veel koolstofverbindingen zijn in staat om elektronen af te staan of op te nemen.
Let wel: als er hier over oxidatie wordt gesproken, dan wordt niet bedoeld de directe verbranding met zuurstof.
Haast alle stoffen uit de koolstofchemie zijn wel te verbranden tot koolzuurgas en waterdamp, maar daarover gaat het hier niet!
Wel geef ik even een kort een overzicht van directe en indirecte verbranding, maar daarna gaan we naar de bedoelde redoxreacties.
Volledige verbranding
Een mooi voorbeeld van volledige verbranding (maar toch in stappen) zie je in opdracht 39.
Hier krijg je alvast de reactie:
Vrijwel alle koolstofverbindingen (met C en H en andere elementen) reageren sterk met zuurstof.
Het meest reactieve element is dan waterstof dat meteen - in contact met zuurstof - water vormt.
Daarna (d.w.z. het gebeurt vrijwel gelijktijdig) reageert het koolstof en vormt CO2. Eventueel aanwezig S of N of P of ander elementen kunnen meer producten maken zoals SO2 en de stikstofoxides NxOy. Deze (gasvormige) producten zijn verantwoordelijk voor de luchtvervuiling.
Logisch dat de beste benzine zo weinig mogelijk zwavel en stikstof bevat.
Onvolledige verbranding
Dat vindt plaats als er onvoldoende zuurstof is.
H gaat als eerste natuurlijk weer over in water, maar om het koolstof te verbranden is dan niet genoeg zuurstof voorradig (er kan bijvoorbeeld niet genoeg lucht bij). Dan vormt zich CO (koolmonoxide) of zelfs kan het koolstof onverbrand blijven (roetvorming).
Zorg er voor dat je altijd de stoffen verbrandt bij voldoende luchttoevoer.
Koolmonoxide wordt ook wel kolendamp genoemd, dat herinnert aan de vroegere kolenkachels.
Oxidatiegetal Nox
In module 10 worden de redoxreacties behandeld, inclusief het oxidatiegetal. Je weet dat bij een redoxreactie de oxidatiegetallen van sommige elementen veranderen.
Bij redoxreacties in de koolstofchemie is dat oxidatiegetal niet altijd gemakkelijk vast te stellen. Waar vindt precies de elektronenoverdracht plaats, dat is de vraag, in het bijzonder ten aanzien van het koolstofatoom/atomen.
De redoxtabellen voorzien niet in halfreacties, dus de veranderingen van het oxidatiegetal zul je zelf moeten uitvogelen.
We nemen methanol als voorbeeld:
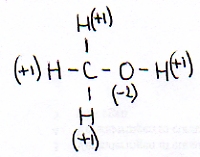
Normaal heeft een H in een verbinding het oxidatiegetal +1 en een O heeft Nox=-2
Deze twee gegevens ken je dus en ook moet je weten dat het hele molecuul neutraal is.
Zo kun je eenvoudig berekenen dat het oxidatiegetal van de C hier -2 moet zijn.
Opdracht 26
Bereken het oxidatiegetal van koolstof in de volgende verbindingen:
- Ethaan
- ethanol
- ethoxi-ethaan
- ethyl-ethan(o)aat
- methaan
Kies antwoord 11-26
Polariteit
Een apolaire koolstofketen oxideren is erg moeilijk (we hebben het nu niet over verbranding met zuurstof dus). De verdeling van de valentie-elektronen is hier zeer gelijkmatig, zonder echte verschillen in elektronegativiteit.
De aanwezigheid van ladingen δ+ en δ- kan nucleofyle of elektrofyle aanvallen veroorzaken met redoxreacties als gevolg.
Als aan de koolstofketen al een zuurstofatoom vast zit kan die polaire plek gemakkelijk redox ondergaan (elektronenoverdracht).
Het zuurstofatoom, of andere atomen met flinke elektronegativiteit, veroorzaakt de gewenste polariteit in de stof.
Niet alleen is er polariteit nodig, maar ook een plaats waar meer zuurstofatomen (of andere sterk elektronegatieve atomen) zich kunnen aanhechten.
Een vuistregel is dan ook:
Een C kan worden geoxideerd als die C tegelijk:
een O heeft én een H waar een andere O zich kan plaatsen tussen de C en de H.
anders gezegd: Om een koolstofverbinding te oxideren is nodig dat er al een zuurstof-atoom aan het te oxideren C-atoom vastgekoppeld is en bovendien moet er aan die te oxideren C minstens nog één H-atoom vast zitten.
Normaal wordt dan tijdens de oxidatie een O geplaatst tussen die bedoelde C en H:
H wordt dan dus: OH / Er wordt dus eigenlijk een H vervangen door een OH.
Let op:
ethermoleculen hebben een O-atoom tussen twee C-atomen in zitten. Daar is sprake van een zekere symmetrie en dus minder polariteit; dan is oxidatie weer een stuk moeilijker.
Een binding tussen twee koolstofatomen is bij gewone oxidatie heel moeilijk te verbreken; koolstofketens blijven meestal ongewijzigd (behalve natuurlijk weer als het een direkte verbranding met zuurstof betreft) waarbij koolzuurgas en water ontstaan.
Opdracht 27
Leg uit of onderstaande stoffen wel of niet te oxideren zijn met aangezuurd dichromaat:
- butaan
- 2-methyl,propanol-2
- aceton
- methoxi-ethaan
Halfreacties
Enkele verbindingen uit de koolstofchemie vind je in redoxtabel; de meeste echter niet.
Je zult dus in staat moeten zijn om halfreacties zelf op te stellen en te achterhalen hoeveel elektronen er per oxidator of reductor worden overgedragen. Normaal kun je die halfreacties direkt uit de tabel aflezen, maar nu dus even niet.
Opdracht 28
Bij de oxidatie van 1-propanol met aangezuurd permanganaat gaat dit propanol over in propanal.
- Schrijf de elektronenformules op van die twee organische verbindingen en vergelijk het (totaal) aantal valentie-elektronen.
- Schrijf vervolgens de twee halfreacties op in molecuulformules.
Je ziet dat het propanol een elektronenpaar verliest, dus is het een reduktor.
Het kloppend maken van zuurstofatomen doe je normaal met watermoleculen; het kloppend maken van H-atomen doe je met ionen H+.
Als deze stoffen vóór de pijl komen te staan, mag dit alleen als water en/of zuur ook werkelijk als hulpstoffen aanwezig zijn.
Alkanen


Alkanen zijn moeilijk te oxideren, behalve natuurlijk de verbranding met zuurstof. Denk maar aan aardgas, butagas, enzovoort.
Opdracht 29
Volledige verbranding van aardgas neemt veranderingen in de oxidatiegetallen met zich mee.
Toon deze veranderingen.
Alkanolen

Alkanolen worden meestal geoxideerd met aangezuurd permanganaat of met aangezuurd dichromaat; d.w.z. met een vrij sterke oxidator.
Voor alkanalen zijn zulke sterke oxidatoren niet nodig; zwakkere oxidatoren als Ag+ of Cu2+ zijn voldoende sterk om het doel te bereiken als tenminste voldaan wordt aan enkele voorwaarden die verderop genoemd worden. Alkanalen worden dus gemakkelijker geoxideerd dan alkanolen.
Als je een alkanol oxideert ontstaat aanvankelijk een stof met twee OH-goepen aan één C-atoom (controleer dat).
Zoals al gezegd, is zo'n verbinding met meer OH-groepen aan één C niet stabiel; van de twee OH-groepen zal een watermolecuul worden afgesplitst.
Er blijft dan een dubbelgebonden O over. (alkanal, alkanon, alkaanzuur).
Opdracht 30
Leg uit wanneer er op deze manier een alkanal, een alkanol of een alkaanzuur ontstaat.
Je kunt ook alkanolen / alkoholen direct verbranden natuurlijk en je krijgt dan het bekende koolzuurgas en water.
Maar nu hebben we het over de subtielere manier met wat zwakkere oxidatoren en met bijzondere producten:
het ion dichromaat in zuur milieu kan een primair alkanol oxideren in twee stappen (via het intermediair alkanal) tot eindproduct alkaanzuur.
Opdracht 31
De volgende stoffen kunnen geoxideerd worden met dichromaat? Ja of nee.
Zoja, wat is het product? En bewijs je antwoord.
- 2-propanol
- Etaandiol (glycol)
Opdracht 32
bewering: "2-methyl 2-propanol kan worden geoxideerd met permanganaat-ionen."
Is deze bewering waar of onwaar? Leg je antwoord uit.
Opdracht 33
Tijdens de oxidatie van 1-propanol met permanganaat(aq), in aanwezigheid van zwavelzuur, verandert het propanol in propanal.
- Geef de elektronenformules van de twee organische stoffen en vergelijk het aantal aanwezige valentie-elektronen.
- Geef ook de twee halfreacties in molecuulformules.
N.B.:
Bij de oxidatie van een alkohol (alkanol) is de eerste stap de vorming van een C-atoom met twee OH-groepen (controleer dat!).
Je weet al dat zo'n toestand niet stabiel is; de twee OH-groepen aan één C-atoom splitsen een watermolecuul af en laten een C met een dubbelgebonden O achter (alkanal, alkanon, carbonzuur)
Alkanalen


Voor de oxidatie van alkanalen (gaat vrij goed) gebuiken we vaak ook aangezuurd permanganaat of aangezuurd dichromaat.
Toch zijn deze oxidatoren wat sterker dan nodig.
Een alkanal bezit een aldehydegroep (-CHO) en de binding C=O is behoorlijk polair waardoor oxidatoren graag aanvallen op het δ+-deel.
Zwakke oxidatoren zoals zilver- en koper(I)-ionen zijn al sterk genoeg om alkanalen te oxideren, waarbij het product een carboxylgroep is, een zuur dus.
Dus: het is gemakkelijker een alkanal te oxideren dan een alkanol.
Opdracht 34
- Wat zal het product zijn bij de oxidatie van ethanal?
- Idem voor de oxidatie van methanal (n.b.: hier hebben we een bijzondere situatie!!)
Alkanonen

Bij de alkanonen is er weliswaar sprake van een aardige polariteit tussen de C en de O van de C=O groep, maar diezelfde C heeft geen extra H-atoom meer, waar een eventuele oxidatie zou moeten plaats vinden.
Het gaat dus niet. Alleen met echt krachtige oxidatoren kan er iets gedaan worden en dan alleen als de C - C-binding wordt stukgemaakt.
Opdracht 35
Beweringen:
- Alkanon bevat een polaire groep
- Alkanon kan niet gemakkelijk worden geoxideerd
Zijn deze beweringen waar? Leg je antwoord uit zonder in de tekst te kijken.
Alkaanzuren
Organische zuren zijn normaal gesproken niet goed te oxideren evenals ethers en esters.
Opdracht 36
Verklaar waarom de die zuren niet goed te oxideren zijn en leg ook uit waarom mierezuur en oxaalzuur hierop een uitzondering zijn.
Opdracht 37
Laat met behulp van elektronenformules zien hoe oxaalzuur(ethaandizuur) als reduktor kan optreden.
Opdracht 38
Beweringen:
- Methaanzuur wordt gemakkelijke geoxideerd
- Ethaanzuur wordt gemakkelijk geoxideerd
Zijn die beweringen waar? Leg uit.
Kies antwoord 11-38
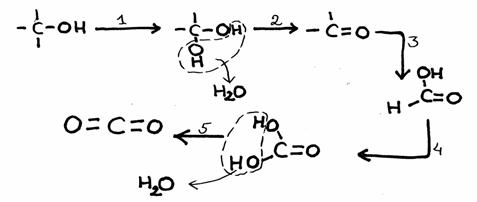
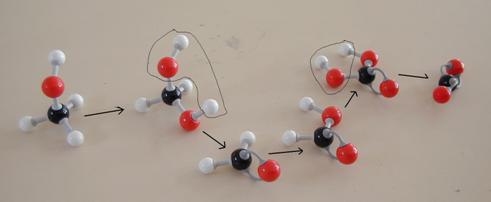
Opdracht 39
Bestudeer het reactieschema hieronder. Het heeft vijf stappen.
- Van elke stap moet je aangeven of het een redoxreactie is of niet.
Zoja, wat kan de oxidator zijn?

N.B.
- In deze gevallen gaat oxidatie gepaard met de invoering van een O-atoom tussen een C en een H
- meestal is bij organische stoffen de aanwezigheid van meerdere OH-groepen aan één C onstabiel
- de eindproducten zijn kooldioxide en water.
- Probeer deze reactie - als er modellen tot je beschikking staan - na te bootsen.
Ethers
Weliswaar zit hier een O tussen twee C-atomen in, dus moet er wat polariteit zijn, maar er is ook grote symmetrie.
We kunnen daarom geen grote polariteit verwachten en het zal daarom moeilijker zijn om ethers te oxideren.
Opdracht 40
Leg de eventuele mogelijkheid uit van oxidatie met aangezuurd dichromaat van:
- Butaan
- 2-methyl propanol-2
- aceton
- methoximethaan
Het is moeilijk organische zuren te oxideren. Niet omdat er geen polariteit zou zijn, maar wel omdat er aan de polaire Cδ+, waar de O zich zou moeten binden, geen H meer zit. Hetzelfde kan gezegd worden voor esters.
Opdracht 41
Methaanzuur en dicarbonzuur kunnen gemakkelijk worden geoxideerd.
- Leg uit waarom deze twee zuren (ook genoemd mierezuur en oxaalzuur) uitzonderingen zijn op de algemene regel.
- In het geval van oxaalzuur, geef de elektronenformules van het reagens en van het product en leg het verschil uit.
terug naar start