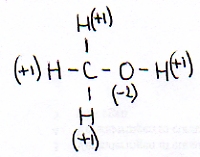Oxidatiegetal Nox
Het oxidatiegetal is het aantal elektronen dat - geheel of gedeeltelijk - door een of ander deeltje wordt opgenomen of afgestaan
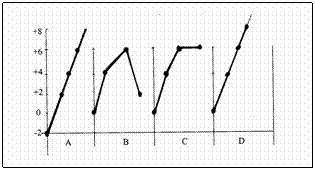
Het diagram hierboven toont de veranderende oxidatiegetallen van zwavel in het productieproces van zwavelzuur.
Het proces kan in grove lijnen als volgt worden aangegeven:
S  SO2
SO2  SO3
SO3
 H2SO4
H2SO4
De grafiek C geeft als enige die veranderende oxidatiegetallen juist weer.
N.B.
- Neutrale elementen krijgen een oxidatiegetal met waarde 0 (de atomen hebben geen elektronen verloren of gewonnen).
- Waterstof neutraal heeft dus oxidatiegetal 0, maar in verbindingen is het vrijwel altijd +1.
- Zuurstof als element heeft oxidatiegetal 0, maar in verbindingen is het meestal -2.
In module 10 worden de redoxreacties behandeld, inclusief het oxidatiegetal. Je weet dat bij een redoxreactie de oxidatiegetallen van sommige elementen veranderen.
Bij redoxreacties in de koolstofchemie is dat oxidatiegetal niet altijd gemakkelijk vast te stellen. Waar vindt precies de elektronenoverdracht plaats, dat is de vraag, in het bijzonder ten aanzien van het koolstofatoom/atomen.
De redoxtabellen voorzien niet in halfreacties, dus de veranderingen van het oxidatiegetal zul je zelf moeten uitvogelen.
We nemen methanol als voorbeeld:
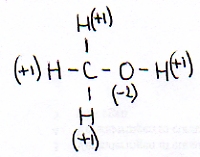
Normaal heeft een H in een verbinding het oxidatiegetal +1 en een O heeft Nox=-2
Deze twee gegevens ken je dus en ook moet je weten dat het hele molecuul neutraal is.
Zo kun je eenvoudig berekenen dat het oxidatiegetal van de C hier -2 moet zijn.

 SO2
SO2  SO3
SO3
 H2SO4
H2SO4