Het oxideren van diverse functionele groepen
Alkanen


Alkanen zijn moeilijk te oxideren, behalve natuurlijk de verbranding met zuurstof. Denk maar aan aardgas, butagas, enzovoort.
Volledige verbranding van aardgas neemt veranderingen in de oxidatiegetallen met zich mee.
Alkanolen
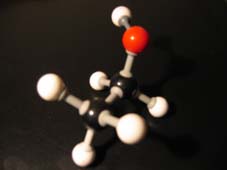

Alkanolen worden meestal geoxideerd met aangezuurd permanganaat of met aangezuurd dichromaat, d.w.z. met een vrij sterke oxidator.
Voor alkanalen zijn zulke sterke oxidatoren niet nodig; zwakkere oxidatoren als Ag+ of Cu2+ zijn voldoende sterk om het doel te bereiken als tenminste voldaan wordt aan enkele voorwaarden die verderop genoemd worden. Alkanalen worden dus gemakkelijker geoxideerd dan alkanolen.
Als je een alkanol oxideert ontstaat aanvankelijk een stof met twee OH-goepen aan één C-atoom (controleer dat).
Zoals al gezegd, is zo'n verbinding met meer OH-groepen aan één C niet stabiel; van de twee OH-groepen zal een watermolecuul worden afgesplitst.
Er blijft dan een dubbelgebonden O over. (alkanal, alkanon, alkaanzuur).
Je kunt ook alkanolen / alcoholen direct verbranden natuurlijk en je krijgt dan het bekende koolzuurgas en water.
Maar nu hebben we het over de subtielere manier met wat zwakkere oxidatoren en met bijzondere producten:
het ion dichromaat in zuur milieu kan een primair alkanol oxideren in twee stappen (via het intermediair alkanal) tot eindproduct alkaanzuur.
N.B.:
Bij de oxidatie van een alkohol (alkanol) is de eerste stap de vorming van een C-atoom met twee OH-groepen (controleer dat!).
Je weet al dat zo'n toestand niet stabiel is; de twee OH-groepen aan één C-atoom splitsen een watermolecuul af en laten een C met een dubbelgebonden O achter (alkanal, alkanon, carbonzuur)
Alkanalen


Voor de oxidatie van alkanalen (gaat vrij goed) gebruiken we vaak ook aangezuurd permanganaat of aangezuurd dichromaat.
Toch zijn deze oxidatoren wat sterker dan nodig.
Een alkanal bezit een aldehydegroep (-CHO) en de binding C=O is behoorlijk polair waardoor oxidatoren graag aanvallen op het δ+-deel.
Zwakke oxidatoren zoals zilver- en koper(I)-ionen zijn al sterk genoeg om alkanalen te oxideren, waarbij het product een carboxylgroep is, een zuur dus.
Dus: het is gemakkelijker een alkanal te oxideren dan een alkanol.
Alkanonen

Bij de alkanonen is er weliswaar sprake van een aardige polariteit tussen de C en de O van de C=O groep, maar diezelfde C heeft geen extra H-atoom meer, waar een eventuele oxidatie zou moeten plaats vinden.
Het gaat dus niet. Alleen met echt krachtige oxidatoren kan er iets gedaan worden en dan alleen als de C - C-binding wordt stukgemaakt.
Alkaanzuren
Organische zuren zijn normaal gesproken niet goed te oxideren evenals ethers en esters. Mierezuur en oxaalzuur vormen een uitzondering op die regel.
Bestudeer het reactieschema hieronder. Het heeft vijf stappen.
- De stappen 1 en 3 bevatten een oxidatie, wijziging van oxidatiegetallen. Er is sprake van invoering van een extra zuurstofatoom.
als er alleen maar water wordt afgesplitst, is dat geen oxidatie.
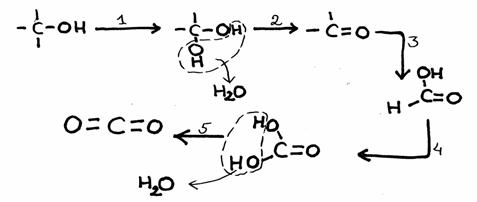
N.B.
- In deze gevallen gaat oxidatie gepaard met de invoering van een O-atoom tussen een C en een H
- meestal is bij organische stoffen de aanwezigheid van meerdere OH-groepen aan één C onstabiel
- de eindproducten zijn kooldioxide en water.
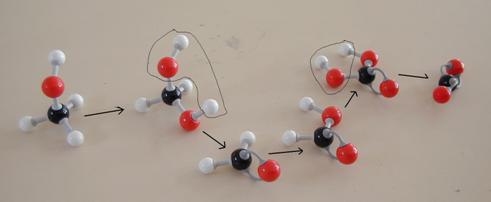
- Probeer deze reactie - als er modellen tot je beschikking staan - na te bootsen.
Ethers
Weliswaar zit hier een O tussen twee C-atomen in, dus moet er enige polariteit zijn, maar er is ook grote symmetrie.
We kunnen daarom geen grote polariteit verwachten en het zal daarom moeilijker zijn om ethers te oxideren.
Het is moeilijk organische zuren te oxideren. Niet omdat er geen polariteit zou zijn, maar wel omdat er aan de polaire Cδ+, waar de O zich zou moeten binden, geen H meer zit. Hetzelfde kan gezegd worden voor esters.
Methaanzuur en dicarbonzuur kunnen gemakkelijk worden geoxideerd.








