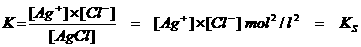KS, Oplosbaarheidsproduct
IP, Ionenproduct
Zouten kunnen goed of slecht oplossen in water, dus veel of weinig ionen produceren, vrijgeven aan het water. De ionen van het opgeloste zout bereiken dan een zekere concentratie en het wiskundige product van deze ionconcentraties noemen we: het Ionenproduct.
Er is altijd wel een ionenproduct, maar niet altijd een oplosbaarheidsproduct. Dat is er alleen voor zouten die niet goed oplossen.
Een "evenwicht" komt pas in zicht als het gaat over slecht oplosbare zouten.
Bijvoorbeeld:
Zilverchloride is een onoplosbaar zout (beter: slecht oplosbaar zout). Echt onoplosbaar zijn zouten vrijwel nooit. Altijd lost er wel een klein beetje op in water. Altijd blijft wel de mogelijkheid voor de ionen in het rooster om daaruit te ontsnappen en het water in te trekken.
Als ze niet allemaal kunnen vrijkomen, omdat het rooster te sterk is bijvoorbeeld, dan krijg je op den duur een evenwichtssituatie waarin de vrije ionen in dynamisch evenwicht zijn met de onvrije in het rooster. Ze ontsnappen, maar zodra positieve en negatieve ionen elkaar tegenkomen, vormen ze weer een rooster.
AgCl(s)  Ag+(aq)+ Cl-(aq)
Ag+(aq)+ Cl-(aq)
Bij het merendeel van dit type evenwichten is de heenreactie endotherm. Dus bij het verwarmen van het mengsel zal het ionenproduct groter worden.
Na het bereiken van het evenwicht en als we de temperatuur constant houden, zullen de concentraties niet meer veranderen.
(let op: de vaste stof AgCl is heterogeen en heeft dus geen concentratie.
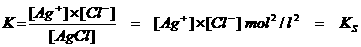
Zo zal elk zout met een kleine oplosbaarheid een KS hebben, genoemd: Oplosbaarheidsproduct
Je kunt dus een slecht oplosbaar zout een heel klein beetje oplossen. Eerst is er een stijgend ionenproduct, maar al heel gauw is het maximum daarvan bereikt: dan is het ionenproduct gelijk aan het oplosbaarheidsproduct. De oplossing is "verzadigd": bij deze bepaalde temperatuur kan niet méér oplossen.
Elk tabellenboek heeft een tabel met de oplosbaarheidsproducten van zouten.
We hebben hier een tabel die ongeveer aangeeft of een zout oplosbaar is.
Het zout zal een evenwicht bereiken met zijn ionen, dus dan veranderen de concentraties niet meer.
Het ionenproduct heeft zijn maximale waarde bereikt = het oplosbaarheidsproduct.
N.B. kijk uit om het oplosbaarheidsproduct en de eigenlijke oplosbaarheid van een zout niet te verwarren met elkaar!
De oplosbaarheid is het aantal MOL van het zout dat per liter water oplossen kan.
De KS is het product van de ionenconcentraties van het zout in een verzadigde oplossing.
Zowel de oplosbaarheid S als het oplosbaarheidsproduct Ks zijn mede afhankelijk van de temperatuur.
In tabel XI kun je van een groot aantal stoffen opzoeken of ze oplossen in water (en in andere oplosmiddelen) en zo ja, hoeveel er dan maximaal kan oplossen; dus wanneer ze verzadigd zijn.
Voor alle stoffen, dus ook voor zouten, is er een verzadigingspunt.
Slecht oplosbare zouten bereiken dit punt zeer snel, goed oplosbare zouten bereiken dit verzadigingspunt pas veel later.
De oplosbaarheid van een zout wordt meestal aangegeven in de eenheid mol/liter, soms in mol/100 gr.
Als een zout in water (gedeeltelijk) oplost, dan valt het ionrooster (ook gedeeltelijk) uit elkaar; er ontstaan dan meer deeltjes.
Het oplossen is afhankelijk van de sterkte van het ionrooster, maar ook van de temperatuur. Bij hogere temperatuur valt meer ionrooster uit elkaar.
Slecht oplosbare zouten zijn zouten waarvan het ionrooster slechts voor een (zeer) klein gedeelte uit elkaar valt in water.
Er is dan sprake van een heterogeen en eenzijdig evenwicht.
Het kleine beetje zilvercarbonaat dat oplost in water(mol/l) heet de oplosbaarheid S bij een bepaalde temperatuur.
Let er op dat in dit voorbeeld uit S mol zilvercarbonaat dus gevormd worden: 2S mol zilverionen en S mol carbonaationen.
De ionen verspreiden zich homogeen door de hele oplossing.
Omdat het vaste en onopgeloste zilvercarbonaat heterogeen aanwezig is mag voor de concentratie daarvan in de evenwichtsvoorwaarde K de waarde 1 ingevuld worden.
De evenwichtsconstante K kan bij deze slecht oplosbare zouten opgevat worden als: het ionenproduct in een verzadigde oplossing.
Het ionenproduct (I.P.) in een verzadigde oplossing van een slecht oplosbaar zout noemt men het OPLOSBAARHEIDSPRODUCT KS
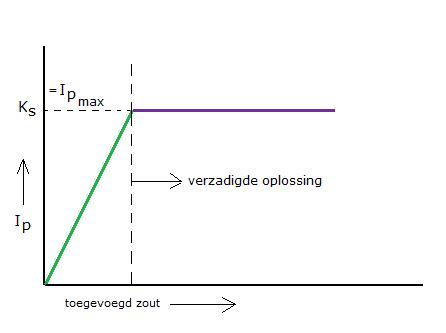
- Zolang er nog onopgeloste stof op de bodem ligt is de oplossing verzadigd (I.P.= Ks).
- Indien dat niet het geval is, dan kan er nog bij en heet het mengsel onverzadigd (I.P.< Ks).
- In bijzondere gevallen kan er ook een oververzadigde oplossing worden gemaakt (I.P. > Ks).
Je moet in staat zijn S te berekenen uit Ks en omgekeerd: Ks te berekenen uit S.
 Ag+(aq)+ Cl-(aq)
Ag+(aq)+ Cl-(aq)