Oplosbaarheid

stof met ionen die in water oplost: Natriumchloride
| Na+
|
Cl-
|
Na+
|
Cl-
|
Na+
|
| Cl-
|
Na+
|
Cl-
|
Na+
|
Cl-
|
| Na+
|
Cl-
|
Na+
|
Cl-
|
Na+
|
| Cl-
|
Na+
|
Cl-
|
Na+
|
Cl-
|
| Na+
|
Cl-
|
Na+
|
Cl-
|
Na+
|
| Cl-
|
Na+
|
Cl-
|
Na+
|
Cl-
|
De ionen Na+ en Cl- die uit een rooster ontsnappen (dat gebeurt aan het oppervlak van het kristal) worden meteen omringd door watermoleculen (door de polaire aantrekkingskrachten).
De ionen trekken elkaar nog wel aan, maar niet genoeg om weer een rooster te vormen. Die watermoleculen zitten in de weg.
We hebben het hier over een oplosbaar zout.
Andere ionen, kleinere of meer geladen, ook omringd door watermoleculen (=gehydrateerd), kunnen vaak wel weer bij elkaar komen en een rooster vormen. Hun onderlinge aantrekking is groot genoeg om daarin te slagen.
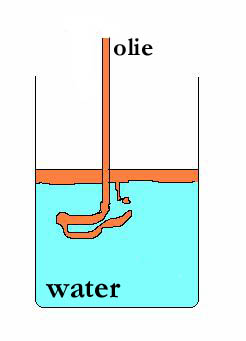
heterogeen mengsel: (voorbeeld) olie + water
De polaire moleculen van water trekken elkaar sterk aan, terwijl de apolaire olie-moleculen bij elkaar blijven en de boel is niet in staat goed te mengen.
Algemene regel voor oplosbaarheid:
- polaire stoffen trekken polaire stoffen aan (zoals suiker dat goed oplost in water)
- niet-polaire stoffen trekken niet-polaire stoffen aan (voorbeeld: vet in benzine)
- polaire stoffen mengen niet met apolaire stoffen (zoals bij water en olie)
SOORT ZOEKT SOORT

