Nylon
Molecuulformule van de monomeer: C12H22N2O2, officiële naam: Polyhexametheenadipamide, dichtheid: 1,2 g/cm3 smeltpunt: 263°C
Structuurformule (skelet) en model:
Nylon kent vele toepassingen: van panty tot kunstgewricht en van muurplug tot klimtouw. Nylon was de eerste commercieel succesvolle polymeer en is heden ten dage niet meer weg te denken in onze maatschappij.
Synthese
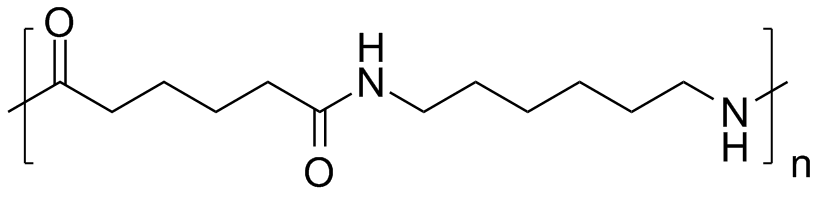
De meeste nylonsoorten worden gesynthetiseerd door condensatiepolymerisatie (polycondensatie) van een dicarbonzuur en een diamine. Er ontstaat een copolymeer waarbij de beide monomeren elkaar in de polymeerketen afwisselen. De bekendste variant is nylon-6,6: de eerste 6 staat voor de 6 koolstofatomen van het diamine (1,6-hexaandiamine) en de tweede 6 voor de 6 koolstofatomen van het dicarbonzuur (adipinezuur).
De klassieke laboratoriumsynthese van nylon 6,6:
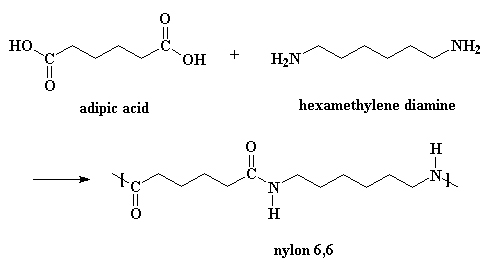
Een katalysator is niet echt nodig, maar zuren versnellen de reactie wel. En kijk, één van de reactanten is een zuur.
Voor meer info over deze reactie, bekijk het reactiemechanmisme
De nylonfilm ontstaat op het grensvlak van een waterige oplossing van 1,6-hexaandiamine en een organische oplossing van adipoyldichloride. Het ontstane polymeer kan met een haakje zacht uit de oplossing getrokken worden, terwijl steeds (doordat het contact tussen te twee lagen voortdurend wordt vernieuwd) verdere polymerisatie optreedt.
De algemene reactie voor de vorming van polyamide uit dicarbonzuur en diamine is:

Hierbij wordt naast nylon ook water gevormd.
In plaats van een dicarbonzuur kan ook een dizuurchloride gebruikt worden, dan wordt waterstofchloride (HCl) in plaats van water gevormd. Hier wordt meestal een base toegevoegd om het vrijkomende waterstofchloride weg te vangen.
Een andere, veel gebruikte nylonsoort is nylon-6. Deze soort wordt gemaakt door polymerisatie van caprolactam. Deze polymerisatie is geen condensatiepolymerisatie, maar een ringopeningspolymerisatie.
Structuur en eigenschappen
Belangrijke eigenschappen van nylons zijn de stijfheid en het smeltpunt. Deze worden bepaald door de krachten waarmee de koolstofketens elkaar aantrekken. Hoe sterker de moleculen elkaar aantrekken, hoe dichter ze in kristallijne vorm tegen elkaar zullen liggen en hoe moeilijker het zal zijn om de band tussen de ketens te verbreken met fysieke kracht of temperatuursverhoging. De aantrekkingskracht tussen de koolstofketens wordt mede bepaald door de waterstofbruggen tussen de CO- en de NH-groepen in naburige ketens.


