Molecuulmassa, molaire massa
Moleculen kunnen veel verschillen in grootte. Zo heeft water kleine moleculen en eiwitten heel grote (macromoleculen).
Ook amilose is groot; het is een polyglucose, opgebouwd uit vele aan elkaar gekoppelde moleculen van glucose.
Het valt niet mee om je de grootte van één deeltje van een stof voor te stellen, zo fantastisch klein zijn die!
Toch bestaan er (relatief) grote verschillen tussen die deeltjes onderling: zo heb je macromoleculen, zetmeel bijvoorbeeld, die zo groot zijn dat ze het water waarin je ze oplost een beetje troebel maken. De véél kleinere suikermoleculen zullen dat nooit doen. Een suikeroplossing blijft altijd een helder transparant mengsel, wat bij de meeste oplossingen in water het geval is.
Ook al kun je deeltjes meestal niet afzonderlijk zien, in de praktijk kun je stoffen wel zien als de deeltjes dicht genoeg bij elkaar zitten, zelfs als die deeltjes klein zijn.
Het zal duidelijk zijn dat het aantal deeltjes, nodig om een stof zichtbaar te maken, enorm groot moet zijn.
"Eén kristalletje suiker kan wel 100.000.000.000.000.000 moleculen C12H22O11 bevatten"
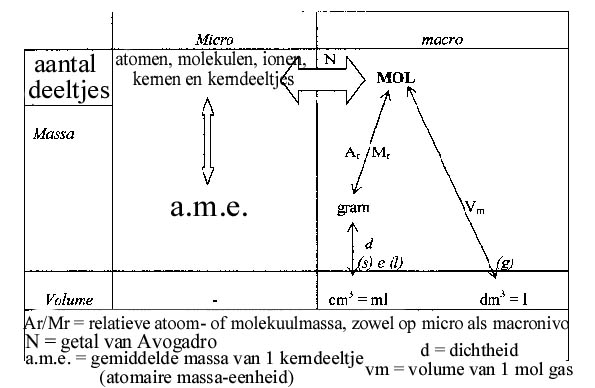
Onderstaand diagram toont de relatie tussen de eenheden op micro-nivo (atomen e.d.) en op macro-nivo (grammen e.d.) met de eenheid MOL in het centrum:
"Als je geen eenheden gebruikt is de molaire massa gelijk aan de molecuulmassa."
