Elke reactie verloopt met zijn bepaalde reactiesnelheid V en met zijn eigen reactiesnelheidskonstante k
k
1 k
3
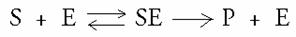
k
2
Uitgaande van drie vooronderstellingen die een ideale / optimale situatie veronderstellen, mag je beweren dat de snelheid maximaal zal zijn,
Vmax

Die drie vooronderstellingen zijn:
- een stationaire toestand (steady state) waarin de concentratie van het intermediair ES niet verandert; de vorming van het ES complex vindt plaats met dezelfde snelheid als waarmee ES verdwijnt.
- Alle aanwezige enzym doet mee;
- Het systeem bevindt zich in een optimale omgeving (verzadigd met S, de beste pH, de beste temperatuur);
Op deze manier bereikt de snelheid van de reactie V haar maximale waarde Vmax
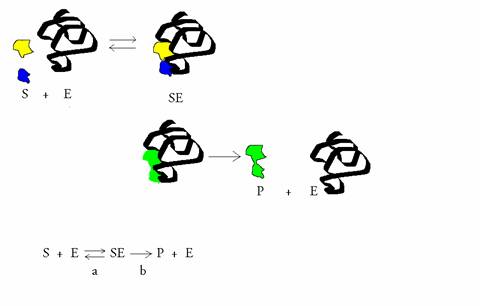
over de vormingssnelheid van het intermediair ES:

over de snelheid van het doorreageren / verdwijnen (in twee richtingen) van dat intermediair ES:


KM is de konstante van Michaelis
Opdracht 40
Leg uit hoe je aan die uitdrukking kan komen, uitgaande van de vooronderstelling 1
Antwoord
KM geeft de affiniteit van het enzym voor het substraat; een lage KM betekent veel ES, oftewel, veel substraat S,
en dat bekent: een lage KM wil zeggen: een grotere snelheid.
De verhouding tussen de reactiesnelheid en de KM kun je zien in de Michaelis Menten vergelijking:

De waarden van KM kunnen variëren van 0 tot duizenden.
Opdracht 41
Lees nauwkeurig de praktikumtaak en probeer deze beschrijving te begrijpen en van je kommentaar te voorzien.:
“Je verdeelt een neutraal speekselextract (pH=7) in twee gelijke delen (A en B).
Deel A wordt aangezuurd met HCl totdat de pH=2. Dit mengsel toont geen activiteit meer.
Deel B wordt vermengd met een gelijk volume water. Dit mengsel vertoont geen activiteit meer.
Daarna behandelen we de beide oplossingen, A en B met base totdat de pH=8,5. Er is geen enzymactiviteit meer.
Tenslotte worden de twee delen met pH 8,5 aangezuurd tot pH=2. Alleen deel B toont weer activiteit.”
Opdracht 42
Probeer de volgende proefbeschrijving te begrijpen, mede gebruik makende van grafieken:
"Bij vergelijking van de enzymen bepalen we de parameters Vmax en Km en meten we de reactiesnelheid (V) als functie van de substraatconcentratie [S]."
Voor een bepaalde standaardhoeveelheid hexokinase of glycokinase meten we de vormingssnelheid (V) van glucosefosfaat (het product G6P) als functie van de glucoseconcentratie [S].
De resultaten tonen aan dat Vmax van de twee enzymen aan elkaar gelijk zijn (er vormen zich ±100 nmol G6P per minuut), maar dat de Km-waarden flink verschillen:
Km van hexokinase = 0,1 mM, Km da glucokinase = 10 nM (factor 100)."
Kijk nog eens goed naar het volgende evenwicht met de tussenstof SE:
k
1
k
3
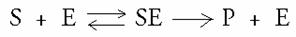
k
2
De Michaelisconstante
 geeft de affiniteit van het enzym voor het substraat.
geeft de affiniteit van het enzym voor het substraat.
De vergelijking van Michaelis-Menten
 geeft de relatie tussen KM en de reactiesnelheid.
geeft de relatie tussen KM en de reactiesnelheid.
We kennen diverse types van enzymremmers:
- productremmers
- drugsremmers
- allosterische remmers
Een bijlage in het Engels over Michaelis Menten
http://www.le.ac.uk/by/teach/biochemweb/tutorials/michment2print.html
terug naar start



