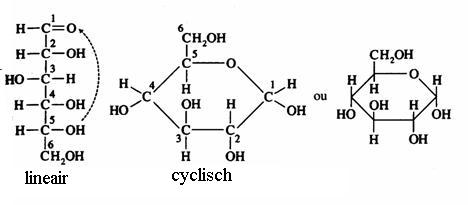
lineair en cyclisch
Je kunt in onderstaande schema zien hoe glucose de lineaire en de cyclische vorm kan aannemen:
De lineaire structuur kan gemakkelijk geoxideerd worden (bezit een aldehydegroep), dus met een zwakkere oxidator; vaak gebruikt men:
Ag+ ammoniakale zilveroplossing = reagens van Tollens. Ook Fehlings' reagens werkt prima (Cu2+)
De cyclische vorm wordt niet gemakkelijk geoxideerd (er is geen =O binding, geen aldehydegroep, beschikbaar).
Het is in de praktijk nu eenmaal zo dat de twee structuren, de lineaire en de cyclische in oplossing met elkaar in evenwicht zijn, dus dat de lineaire structuur er altijd bij zit en die laat zich goed oxideren.
Omdat de lineaire tijdens dat proces verdwijnt en in evenwicht is met de cyclische, zal de cyclische vorm steeds meer overgaan in lineaire vorm, oftewel, alles wordt uiteindelijk toch geoxideerd.
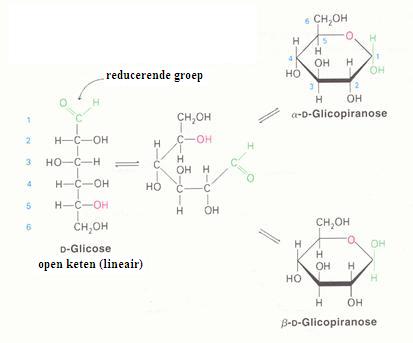
Glucose en fructose komen op twee manieren voor, de lineaire en de cyclische. De twee vormen zijn - in watermilieu, altijd in evenwicht met elkaar.
Toch heeft alleen de lineaire structuur de juiste groep om te oxideren (de reductorgroep, de aldehydegroep).
Tijdens het redox-proces verdwijnt toch niet alleen de lineaire vorm, maar ook de cyclische vorm (vanwege het evenwicht).
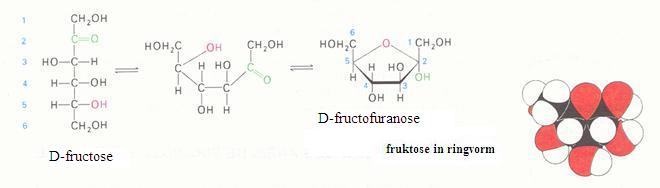
De oxideerbaarheid van een cyclische structuur van disacchariden hangt af van de plaats van de O (zuurstofatoom) tussen twee ringen.
Als zo'n C - O binding in de ring gemakkelijk is te openen (waarbij de lineaire structuur ontstaat) dan is oxidatie mogelijk.




