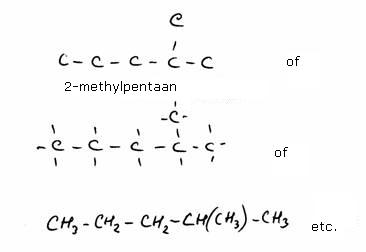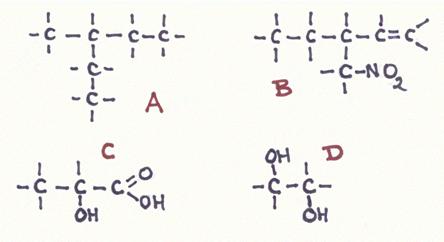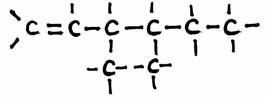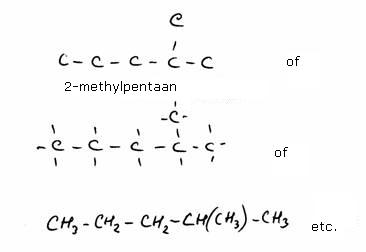
De hoeveelheid stoffen in de organische scheikunde (koolstofchemie) is onvoorstelbaar groot.
De belangrijkste oorzaak is die mogelijkheid van koolstofatomen om aan elkaar te koppelen en korte of heel lange koolstofketens te vormen. Een goede nomenclatuur (naamgeving) met basisregels voor al die koolstofketens is daarom noodzakelijk.
Die ketens kun je in de scheikundeboeken op diverse manieren tegenkomen. Soms zijn ze heel gedetailleerd getekend, met alle atomen zichtbaar, soms zie je ze als een soort skelet, waarbij lang niet alle atomen en bindingen erbij staan.
Zonder kennis van de basisregels is het niet mogelijk de beroemde internationale nomenclatuur te begrijpen of te beheersen.
Als consequentie van zijn bijzondere karakter kan het C-atoom ketens vormen met enkelvoudige, dubbele, drievoudige en zelfs cyclische
bindingen, niet alleen met koolstof, maar met vele andere atomen.
Er zijn zoveel verschillende moleculen gebaseerd op het koolstofatoom, dat we spreken van een koolstofchemie,
vroeger, maar eigenlijk kom je dat nog heel vaak tegen, spraken we van organische chemie.
primair, secundair, tertiair en quaternair
Onderstaande structuur is 'metylbutaan' aan de linkerkant en 'dimetilpropaan' aan de rechterkant.
Koolstofatomen die alleen maar gekoppeld zijn aan één ander C-atoom heten primaire C's; deze zitten altijd aan het eind van een
koolstofketen.
C-atomen tussen twee andere in noemen we secundaire C-atomen.
Zo zijn er ook tertiaire C-atomen, gekoppeld aan drie andere, en quaternaire die ingeklemd zitten tussen vier andere C-atomen.
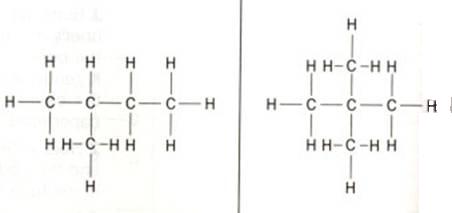
Opdracht 18
Hoeveel primaire, secundaire, tertiaire en quaternaire C-atomen zitten in de twee structuren?
De woorden primair, enz. gebruikt men niet alleen voor de C-atomen. Ook andere atomen of atoomgroepen kunnen deze kwalifikatie bezitten.
Als bijvoorbeeld een OH-groep vast zit aan een secundair C-atoom, spreken we van een secundaire alkohol of ook van een secundaire hydroxigroep.
Bij de eiwitten zul je ook die termen primair, enz. tegenkomen, maar dan betekenen ze iets anders.
Opdracht 19
Beantwoord de volgende vragen over de structuren A, B, C e D:
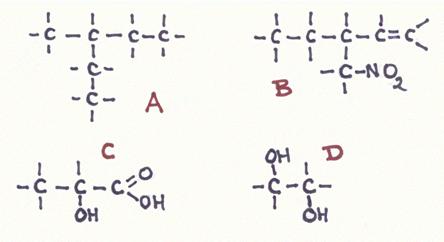
- Geef de officiële naam van elke structuur;
- Hoeveel secundaire koolstofatomen heeft elke structuur?
- Zie je ergens een secundaire OH-groep? Waar?
- Zijn alle hoofdketens tegelijk ook de langste ketens?
Kies antwoord 04-19
Opdracht 20
Welke specifieke groepen herken je in de structuur?
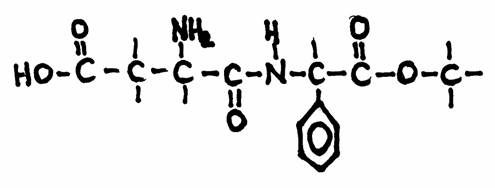
Dit is de structuur van 'aspartaam', een vervanger voor gewone suiker voor personen die op moeten passen
(diabetici, of mensen die bang zijn om dik te worden).
Aspartaam heeft een effect 100x zo sterk als gewone suiker:
1 gram suiker kun je vervangen door 10 mg aspartaam
andere vervangers zijn: fructose (1,7x suiker) en sacharine (400x suiker)
De koolstofverbindingen bevatten altijd een hoofdketen van koolstofatomen.
In de nomenclatuur is het eerste wat je doet: de hoofdketen opzoeken en herkennen.
- Kies als hoofdketen altijd:
- de langst mogelijke keten, maar ook en tegelijk:
- die keten waar eventuele dubbele of drievoudige bindingen in zitten.
- De hoofdketen kan vertakkingen hebben of functionele groepen zoals een OH-groep
- Indien nodig voeg je nummers toe om aan te geven aan welke plaats in de hoofdketen de vertakking, de speciale bindingen of functionele groepen aangekoppeld zitten. Daarbij moet je altijd proberen een zo laag mogelijke nummering te krijgen.
Regels voor de nomenclatuur, hier voor alifatische koolwaterstoffen
Elke koolstofverbinding heeft een hoofdnaam, gebaseerd op het aantal C-atomen in de hoofdketen:
Met..., et..., prop..., but..., pent..., hex..., hept..., oct..., non..., dec..., in het algemeen: alc...
op de puntjes verschijnen achtervoegsels:
- aan: de hoofdketen heeft alleen enkelvoudige bindingen.
- een: de hoofdketen heeft ook dubbele bindingen.
- yn: de hoofdketen heeft ook drievoudige bindingen
- yl: dan gaat het over een vertakking, dus niet de hoofdketen.
Voorbeelden:
Propeen is een molecuul met een keten van drie C-atomen met een dubbele binding.
De positie van de dubbele en drievoudige bindingen worden met nummers aangegeven, indien nodig.
3-etyl is een vertakking, een zijtak, van twee C-atomen, en die gekoppeld is aan de derde C van de hoofdketen.
Behalve achtervoegsels zijn er ook vele voorvoegsels:
- Mono, di, tri, tetra, penta, hexa, hepta, octa, nona, deca
zij duiden 1 tot 10 aan en geven het aantal van een bepaald groepje.
- Ciclo
dan is de hoofketen niet lineair, maar circulair.
Voorbeeld: 3,4-dimetyl,1-hexeen:
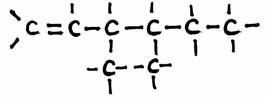
N.B
H-atomen kunnen eventueel weggelaten worden in de structuurformule.
Opdracht 21
Zo mogelijk moet je nu met modellen gaan werken en proberen de volgende moleculen te bouwen:
metaan (ruimtelijke vorm heet hier: tetraëder); benzine (de belangrijkste isomeer van octaan); etheen; acetileengas (ethyn) dat gebruikt wordt bij lassen.
De koolwaterstoffen kunnen uit de aardlagen gehaald worden, diep onder de aarde of onder de zee of oceaan. Je treft ze aan in:
- ruwe aardolie
- aardgas
Op alle bijbehorende processen komen we later in andere modules terug. Nu gaat het alleen over de nomenclatuur.
De homologe reeks
Zo'n reeks bevat stoffen met een één type functionele groep, met eenzelfde algemene formule en met gelijksoortige eigenschappen.
Bijvoorbeeld: alle alkoholen hebben een OH-groep, een algemene formule CxHyOH. Maar je hebt ook ethers en esters enz.
De verschillen tussen de leden van een homologe serie hangen onder andere af van de lengte van de koolstofketen CxHy.
Zo zal methanol veel gemakkelijker verdampen dan propanol. Maar chemisch vertonen ze veel gelijksoortige reacties.
(on)verzadigd
Een koolstofketen kan verzadigd zijn of onverzadigd, afhankelijk van de aanwezigheid van dubbele of drievoudige bindingen tussen de koolstofatomen.
Later komen we terug op de typische reacties van onverzadigde bindingen, die namelijk geopend kunnen worden en dan 'verzadigd' worden
door er iets aan toe te voegen.
terug naar start