Kolencentrale
Een mooie beschrijving van de kolencentrale vind je bij wikipedia, op het Internet:
klik op: Kolencentrale
Een korte samenvatting volgt hieronder, hier en daar met wat toevoegingen.
Een kolencentrale is een thermische elektriciteitscentrale die met steenkool wordt gestookt.
De bijbehorende scheikundige reactie is eenvoudig:
C(s) + O2(g)  CO2(g)
CO2(g)
Vanzelfsprekend worden alle andere stoffen die in de steenkool zitten, mee verbrand. Daarbij moet je vooral denken aan Zwavel en Stikstof die bij verbranding oxiden opleveren: NO, NO2 en SO2. Deze oxiden kunnen in de lucht, met watere (regen) zuren veroorzaken (zure regen).
Behalve die gasvormige oxiden, ontstaat ook 'fijnstof', een soort vrijwel niet zichtbaar roet, allemaal slechte voor de volksgezondheid.
En er ontstaan grote hoeveelheden kooldioxide, CO2, dat niet zozeer de gezondheid schaadt, maar tot de broeikasgassen behoort. CO2 verhoogt de temperatuur op de aarde.
Kolencentrales worden om deze redenen als de meest milieuschadelijke vorm van energieopwekking beschouwd.
Op Internet kun je een mooi werkingsschema vinden van een kolencentrale in Zeeland
Bekijk het filmpje. Hieruit even apart genomen het onderstaande schema, dat je goed moet bestuderen. Zorg dat je precies doorhebt hoe de centrale in elkaar zit.
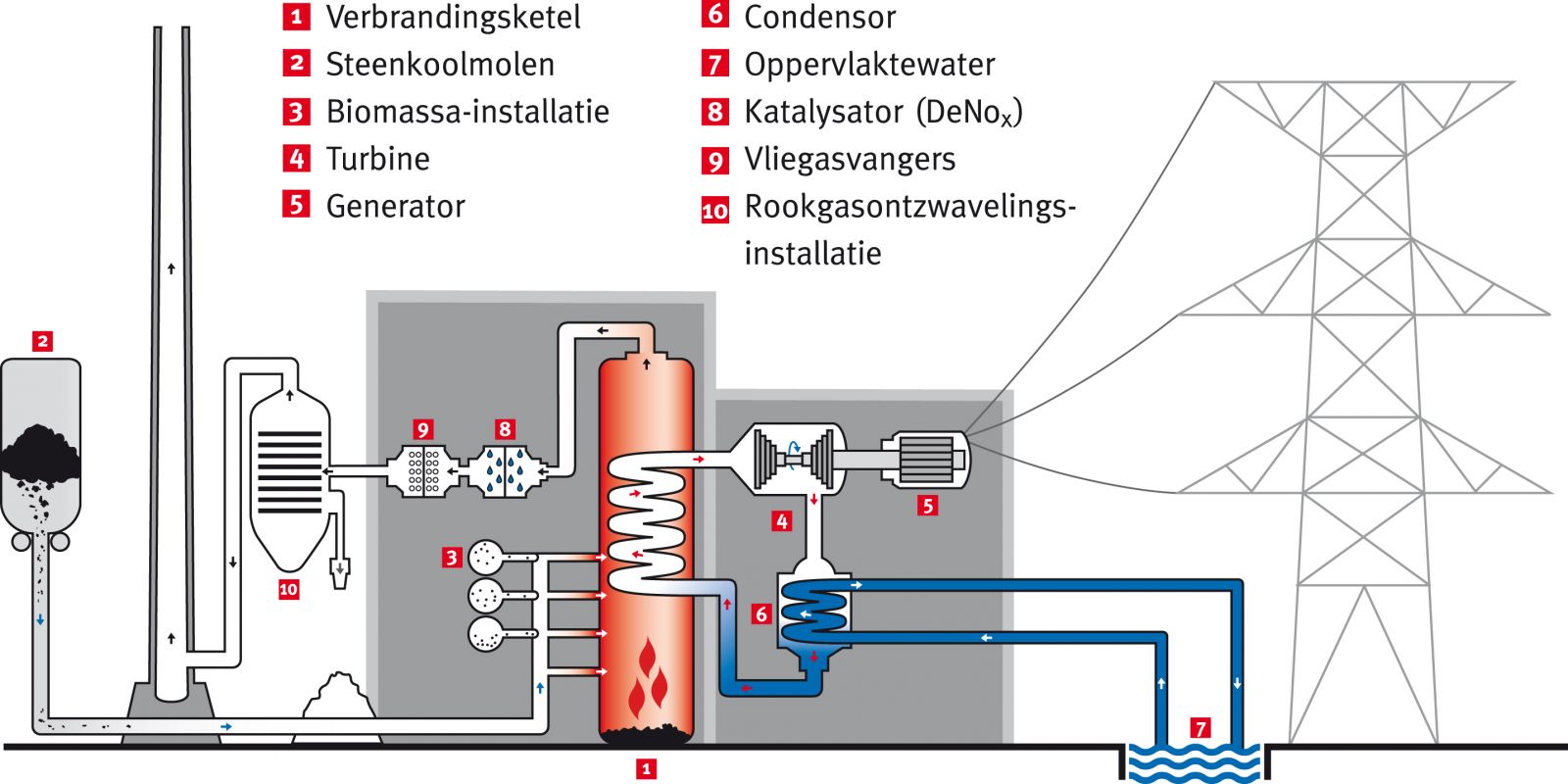
Zoals je ziet worden de kolen verbrand. Met de hitte die daarbij vrij komt, wordt stoom oververhit waarmee een turbine aan het draaien wordt gezet (een soort stoommachine dus). Aan die turbine zit een generator vast, die meedraait en zo stroom opwekt.
Maar je ziet dat er ook een grote hoeveelheid chemie aan te pas komt:
- De steenkool wordt soms van te voren zeer fijn vermalen, maar soms worden ze vergast. Vermalen of in gasvorm wordt de kool dan verbrand met zuurstof.
- stikstofoxiden worden 'afgevangen', zodat die niet in het milieu komen. Hierbij wordt een katalysator gebruikt
- as (die bij de verbranding overblijft) wordt opgevangen en afgevoerd
- zwaveloxiden worden 'afgevangen', zodat die niet in het milieu komen
Of dat allemaal goed gaat, en over wat er uit de centrale, ondanks al die instrumenten, toch ontsnapt zijn de meningen verdeeld.
In elk geval komt er heel veel kooldioxide in de atmosfeer, met klimaatveranderingen tot gevolg. Belangrijk is ook waar de steenkool vandaan komt. De kwaliteit ervan kan heel erg verschillen.
Om enig idee te krijgen over hoe enorm die machines zijn, de onderstaande foto, ook van Internet:

Op Internet vind je nog meer info, en wel over de kolencentrale in Amsterdam:
Interessant is hier dat ze er trots op zijn de uitstoot van de stikstofoxiden met 35% te verminderen. Bedenk daarbij wel dat dus 65% nog steeds in de lucht komt en dat is nogal wat!
Hieronder volgen een aantal extra scheikundige aspecten die met bovenstaande te maken hebben.
1.
Bij de verbranding komen dus stikstofoxiden vrij, vaak aangeduid met NOx. Die x slaat op het feit dat stikstof verschillende verbindingen met zuurstof kan maken:
NO, NO2, N2O3, N2O4, N2O5 en N2O (lachgas)
Met name de eerste twee komen nogal eens samen voor en worden 'nitreuze dampen' genoemd. NO2 is lichtbruin tot rood van kleur, NO is kleurloos en N2O4 (dat er soms ook in zit) heeft een lichtbruine kleur. Als je het inademt, merk je dat het verstikkend werkt, net als chloorgas.
Nitreuze dampen zijn sterk oxiderend en schadelijk voor de gezondheid.
2.
Bij het verbranden van steenkool kan het ook misgaan als er niet voldoende zuurstof wordt toegevoerd.
Normaal vormt zich kooldioxide (CO2), maar bij onvoldoende zuurstof kan ook koolmonoxide ontstaan (CO), een kleurloos en reukloos gas, maar zeer giftig. Het molecuul lijkt zo op zuurstofmoleculen dat de rode bloedlichaampjes "denken" dat het zuurstof is. Maar als CO daar eenmaal zit, wil het niet meer weg en blijft er steeds minder plaats voor zuurstof. Zo komt het zuurstoftransport stil te liggen met als gevolg een langzaam, maar dodelijk inslapen zonder dat je het in de gaten hebt.
2C(s) +O2(g)  2CO(g)
2CO(g)
In de steenkoolcentrales wordt elektrische energie opgewekt, waarbij gebruikt wordt gemaakt van chemische en fysische processen.
In dit geval is er sprake van een continuproces. De steenkool wordt, eventueel na vergruizing, continu aangevoerd voor verhitting/verbranding. Zo is de leverantie van elektrische stroom is zeer stabiel te regelen.
De grondstof is natuurlijk steenkool. De belangrijkste hulpstof is water, dat zelf niet mee reageert, maar wel bij de verbranding van steenkool op hoge temperatuur wordt gebracht.
Helaas zijn er nogal wat afvalstoffen, met name de oxiden van stikstof, zwavel en koolstof.
De chemische technologen zoeken ongetwijfeld naar de veiligste, maar ook naar de meest economische oplossing voor het proces. Alle (regel)apparatuur staat onder hun beheer en toezicht. Ze definiŽren en controleren de chemische reacties.
 CO2(g)
CO2(g)
CO2(g)

2CO(g)