In module 7 wordt het volgende behandeld over de reactiesnelheid:
V = k.[conc.]n
- V : de snelheid;
- k : de samenstelling van andere konstante factoren;
- n : de coŽfficiŽnt van het reagens in de reactievergelijking;
Als je deze formule toepast op zowel de heen- als de terugreactie
2HI  I2 + H2
I2 + H2
komen we bij het volgende resultaat:
Vheen = kheen x [HI]2
en
Vterug = kterug x [I2] x [H2]
Let op: in principe zullen de concentraties van de stoffen in een evenwicht nooit helemaal 0 worden, en dat wil zeggen dat ook de snelheden niet 0 worden, zoals dat wel gebeurt bij ťťnrichtingsreacties.
Opdracht 1
De reactiesnelheid is voor een groot deel afhankelijk van concentraties van de reagerende stoffen:
hoe meer substraat, hoe sneller de reactie.
- Dus op welk moment van de reactie zal de reactiesnelheid het grootste zijn?
- En precies zo voor de terugreactie.
- Hieronder vind je diagrammen van de snelheden en van de concentraties:
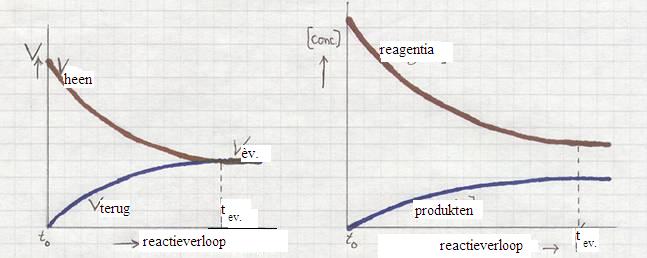
Hoe veranderen de reactiesnelheden van de heen- en terugreactie vanaf de start (t0) tot het bereiken van het evenwicht (teq)?
De evenwichtsvoorwaarde van een chemisch evenwicht is:
de twee reacties (heen en terug) worden niet 0 (behouden een zekere snelheid) en verlopen met gelijke snelheid.
Of Ook: Vheen = Vterug
Opdracht 2
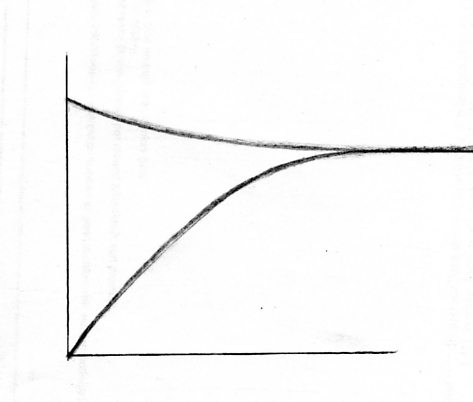
- Zet in het snelheidsdiagram de eenheden en geef aan wat de x-as en y-as voorstellen.
- Welke stoffen zullen gaan domineren gedurende het evenwicht en waarom?
terug naar start


