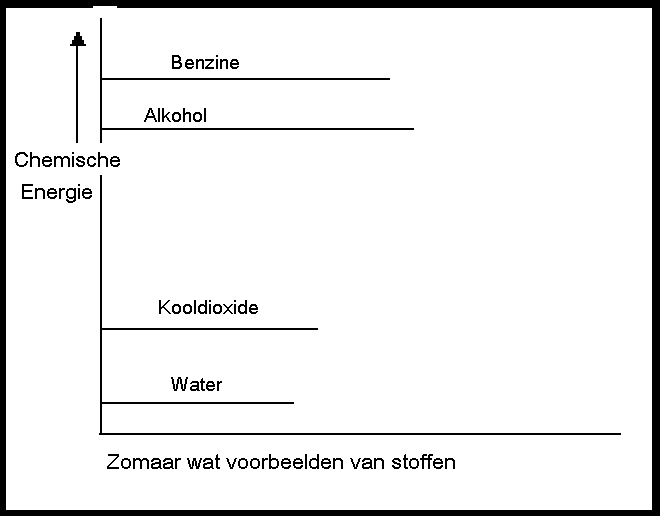
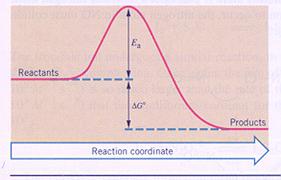
| I | De producten hebben méér energie dan de reagentia | In dit geval hebben de producten dus energie gewonnen, wat alleen kan als het systeem van buitenaf energie heeft verkregen (ΔH > 0). |
| II | De producten hebben minder energie dan de reagentia | Hier hebben de reagentia dus energie verloren; het systeem heeft energie afgestaan naar buiten (ΔH < 0). |
| III | De producten hebben evenveel energie als de reagentia | In dit geval is er sprake van een chemische evenwichtsreactie (ΔH = 0). |